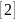- •1 Гетерогенные некаталитические химические
- •1.1 Основные понятия химической кинетики
- •1.2 Гомогенные и гетерогенные системы
- •1.3. Гетерогенные процессы
- •1.3.1 Механизм гетерогенных процессов
- •1.3.2 Равновесие гетерогенных процессов
- •1.3.3 Гетерогенный процесс в системе жидкость — твердое (ж - т)
- •1.3.4 Реакторы для процессов в системе ж-т
- •2 Расчет кривых ликвидуса по исходным данным для системы « »
- •2.1 Расчет кривых ликвидуса по уравнению Шредера-Ле-Шателье
- •2.2 Расчет кривых ликвидуса по уравнению Эпстейна-Хоуленда.
- •2.3 Расчет кривых ликвидуса по методу с.А. Суворова.
- •3 Изучение фазового превращения в системе
- •Оценка термодинамической вероятности образования
- •Р исунок 3.1- График зависимости от т
- •3.2 Описание диаграммы состояния двухкомпонентной системы СаО – МоО3
1.3.3 Гетерогенный процесс в системе жидкость — твердое (ж - т)
Процессы с участием твердых и жидких реагентов служат основой многих химических производств. К таким процессам относятся растворение твердых веществ и кристаллизация из растворов, экстрагирование и выщелачивание, плавление твердых тел и кристаллизация из расплавов, полимеризация в среде жидких мономеров с образованием твердых полимеров, поликонденсация в жидкой фазе с образованием твердых высокомолекулярных продуктов.
Растворение физическое и химическое. Физическое растворение, при котором происходит лишь разрушение кристаллической решетки, обратимо. Химическое необратимое растворение сопровождается такого рода взаимодействиями растворенного вещества с растворителем или с химически активными веществами, присутствующими в растворе, при котором меняется природа растворенного вещества, и его кристаллизация в первоначальном виде невозможна. Наибольшее применение в технике имеет экстрагирование или выщелачивание.
Экстрагированием называется разделение твердых или жидких смесей обработкой их растворителями, в которых компоненты смеси растворяются неодинаково. Твердые вещества экстрагируют из смеси органическими растворителями, минеральными кислотами, щелочами и водой. При выщелачивании в качестве растворителя часто используются вода и оборотные водные растворы. Процессы растворения, экстрагирования, выщелачивания чаще всего сопровождаются кристаллизацией из растворов. Кристаллизация служит для разделения веществ из водных растворов, а также для очистки этих веществ. Кристаллизацию твердых веществ из водных растворов производят различными способами, в зависимости от этих способов различают несколько видов кристаллизации:
Политермическая кристаллизация осуществляется охлаждением насыщенных растворов и применяется для веществ, растворимость которых при повышенных температурах выше, чем при низких.
Изотермическая кристаллизация, производимая испарением воды из растворов при постоянной температуре, используется для солей, растворимость которых мало зависит от температуры. Иногда кристаллизацию осуществляют введением в раствор веществ, понижающих растворимость основной соли. Такой тип кристаллизации называется высаливанием. Кристаллизация из растворов — типичный процесс химической технологии, особенно характерный для производства солей и минеральных удобрений, гидрометаллургических процессов, а также для производства ряда органических полупродуктов и продуктов.
Равновесие в системе Ж-Т основано на правиле фаз и выражается при помощи диаграмм фазового состояния. Анализ диаграмм позволяет определять равновесный выход продукта и максимальное приближение реального производственного процесса к равновесию.
Для обратимых процессов между твердыми и жидкими реагентами подвижное равновесие можно охарактеризовать при помощи константы равновесия реакции в жидкой фазе. При этом применяют упрощенные выражения константы равновесия, включающие только концентрации основных компонентов, находящихся в жидкой фазе.
Кинетика взаимодействия в системе Ж-Т рассматривается на примере процессов растворения и выщелачивания. Обычно процессы растворения идут в диффузионной или переходной области. При физическом обратимом растворении разрушается кристаллическая решетка и частицы твердого вещества переходят в раствор. Скорость физического растворения для данной пары реагентов (Ж — Т) определяется в основном законами диффузии и поверхностью соприкосновения фаз. Скорость растворения и уменьшается при повышении концентрации растворенного вещества С в жидкой фазе по логарифмическому закону в соответствии с кинетическим уравнением физического растворения:
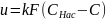
Где k — коэффициент скорости растворения. Коэффициент скорости физического растворения иногда выражают следующим образом:
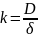
Где
D
— коэффициент диффузии растворенного
вещества;
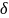 — условная толщина пограничного
диффузионного слоя.
— условная толщина пограничного
диффузионного слоя.
Kритериальное уравнение для скорости растворения взвешенных кристаллов соли выражается следующим образом:
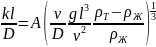
Где l — средний линейный размер частицы; v — кинематический коэффициент вязкости жидкости; рт, рж — плотности твердой частицы и жидкости (растворителя); А — постоянный коэффициент.
Для реакторов с мешалками коэффициент массопередачи k можно определить по уравнению
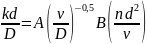
Где А и В — коэффициенты, характеризующие тип мешалки; n — число оборотов мешалки, об/с.
Кинетика растворения, сопровождающегося химическими реакциями, определяется двумя одновременно протекающими взаимосвязанными стадиями: а) процессы на поверхности твердого вещества; б) диффузионный процесс. Скорость химического растворения выражается различным образом в зависимости от характера движущей силы процесса и преимущественного влияния на коэффициент скорости растворения химических или физико-химических факторов. Если на поверхности твердого вещества идет быстрая химическая реакция и в раствор диффундируют только продукты реакции, то движущей силой процесса является концентрация активного вещества растворителя Ср:
U=kfcp.
Такой вид кинетического уравнения характерен для растворения металлов. Возможны и другие типы химического растворения, описываемые более сложными кинетическими уравнениями. При выщелачивании растворимой части пород скорость процесса замедляется в результате дополнительной стадии внутренней диффузии растворителя в поры твердого вещества.
Интенсификацию процессов растворения, выщелачивания, экстрагирования осуществляют увеличением поверхности соприкосновения фаз F, измельчением твердого вещества, увеличением его пористости, повышением относительной скорости перемещения твердой и жидкой фаз.
Повышение
температуры также может служить одним
из наиболее эффективных приемов ускорения
процессов растворения и выщелачивания
как в кинетической, так и
в диффузионной
области. Для процессов растворения в
диффузионной области преимущественным
приемом интенсификации может быть
интенсивное перемешивание, которое
ускоряет диффузию, выравнивает
концентрацию, а при химическом растворении
способствует удалению твердых
продуктов реакции с поверхности
растворяемого вещества. Для химического
растворения, интенсивность перемешивания
ускоряет процесс повышение температуры.
При выщелачивании для повышения средней
движущей силы процесса применяют
противоток твердого материала и
растворителя.