
- •1 Гетерогенные некаталитические химические
- •1.1 Основные понятия химической кинетики
- •1.2 Гомогенные и гетерогенные системы
- •1.3. Гетерогенные процессы
- •1.3.1 Механизм гетерогенных процессов
- •1.3.2 Равновесие гетерогенных процессов
- •1.3.3 Гетерогенный процесс в системе жидкость — твердое (ж - т)
- •1.3.4 Реакторы для процессов в системе ж-т
- •2 Расчет кривых ликвидуса по исходным данным для системы « »
- •2.1 Расчет кривых ликвидуса по уравнению Шредера-Ле-Шателье
- •2.2 Расчет кривых ликвидуса по уравнению Эпстейна-Хоуленда.
- •2.3 Расчет кривых ликвидуса по методу с.А. Суворова.
- •3 Изучение фазового превращения в системе
- •Оценка термодинамической вероятности образования
- •Р исунок 3.1- График зависимости от т
- •3.2 Описание диаграммы состояния двухкомпонентной системы СаО – МоО3
С ОДЕРЖАНИЕ
ОДЕРЖАНИЕ
ВВЕДЕНИЕ 4
1 ГЕТЕРОГЕННЫЕ НЕКАТАЛИТИЧЕСКИЕ ХИМИЧЕСКИЕ ПРОЦЕССЫ 5
1.1 Основные понятия химической кинетики 5-8
1.2 Гомогенные и гетерогенные системы 8
1.3. Гетерогенные процессы 8
1.3.1 Механизм гетерогенных процессов 8-9
1.3.2 Равновесие гетерогенных процессов 9-10
1.3.3 Гетерогенный процесс в системе жидкость — твердое 10-14
1.3.4 Реакторы для процессов в системе Ж-Т 14-16
2 РАСЧЕТ КРИВЫХ ЛИКВИДУСА ПО ИСХОДНЫМ ДАННЫМ ДЛЯ СИСТЕМЫ «ВеF2 – CaF2» 17
2.1 Расчет кривых ликвидуса по уравнению Шредера-Ле-Шателье 17-19
2.2 Расчет кривых ликвидуса по уравнению Эпстейна-Хоуленда. 19-21
2.3 Расчет кривых ликвидуса по методу С.А. Суворова 21-27
3 Изучение фазового превращения в системе
«СаО – МоО3» 28
Оценка термодинамической вероятности образования
химического соединения СаО – МоО3 28-32
3.2 Описание диаграммы состояния двухкомпонентной системы
СаО – МоО3 32-33
ЗАКЛЮЧЕНИЕ 34
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ 35
ВВЕДЕНИЕ
Химическая кинетика – это учение о скоростях химических реакций, о факторах, определяющих эти скорости, а также о механизме химических реакций. Рассматривает количественное описание хода химической реакции во времени при постоянной температуре в зависимости от концентрации реагирующих веществ.
Знание кинетических характеристик химических процессов имеет большое практическое и теоретическое значение, так как позволяет рассчитывать реакторы и различную химическую аппаратуру, находить наиболее общие методы выяснения механизма реакции, изучать поведение участвующих в реакции атомов, радикалов и комплексов.
В отношении кинетики химические реакции разделяют или по признаку молекулярности реакции или по признаку порядка реакции.
Различают гомогенные гетерогенные реакции.
Гетерогенные химико-технологические процессы основаны на реакциях между реагентами , находящихся в различных фазах. Большинство промышленных химико-технологических процессов относится к гетерогенным. Огромное разнообразие гетерогенных процессов затрудняет их классификацию. В соответствии с принятой классификацией некаталитические гетерогенные процессы делят по фазовому состоянию реагентов на процессы в системах Г – Ж, Ж – Т, Г – Т и т.п.
1 Гетерогенные некаталитические химические
ПРОЦЕССЫ
1.1 Основные понятия химической кинетики
Химическая реакция состоит в превращении одного или нескольких химических веществ, называемых исходными веществами, в одно или несколько других химических веществ, называемых продуктами реакции.
Химические
реакции, как правило, являются сложными,
т. е. протекают через ряд элементарных
стадий. Элементарная стадия является
наиболее простой составной частью
сложной реакции: каждый акт элементарной
стадии представляет собой результат
непосредственного взаимодействия и
превращения нескольких частиц.
Совокупность реакций из элементарных
стадий называется механизмом реакции.
При протекании реакции по стадиям
получаются и расходуются промежуточные
вещества.
Промежуточными веществами обычно являются активные частицы с не спаренными электронами, так называемые радикалы. Сложные реакции могут состоять из двусторонних, параллельных и последовательных элементарных стадий. Все элементарные стадии являются двусторонними,
т. е. - состоят из двух взаимно противоположных элементарных реакций, которые одновременно протекают в прямом и обратном направлениях, но с разной скоростью. При параллельном протекании нескольких элементарных стадий данное вещество одновременно расходуется по нескольким путям с образованием разных продуктов. При последовательном протекании элементарных стадий промежуточное вещество, полученное в одной стадии, расходуется другой. Механизм большинства реакций точно не известен, так как промежуточные вещества обычно очень неустойчивы и доказать экспериментально их существование довольно сложно. Поэтому, как правило, у сложных реакций промежуточные вещества неизвестны, а известен только наиболее вероятный механизм, т. е. предполагаемый механизм протекания реакции по стадиям, на основе которого можно получить закономерность, адекватно отражающую основные черты реального процесса.
Таким образом, элементарной стадией химической реакции называется сумма актов химического превращения при одновременном сближении (столкновении) нескольких (обычно двух) частиц; при этом энергия связей перераспределяется между атомами с образованием активированного комплекса с его последующим распадом и получением новых частиц. В случае мономолекулярного акта образование активированного комплекса происходит за счет перераспределения энергии между связями атомов внутри молекулы, как следствие ее активации в результате внешних воздействий.
Важным понятием химической кинетики является скорость химической реакции.
Скорость химической реакции равна изменению количества вещества в единицу времени в единице реакционного пространства. В зависимости от типа химической реакции (гомогенной или гетерогенной) меняется характер реакционного пространства.
Все
химические реакции протекают с различными
скоростями. Некоторые из них полностью
заканчиваются за малые доли секунды,
другие осуществляются за минуты, часы,
дни, также известны реакции, требующие
для своего протекания несколько лет,
десятилетий и еще более длительных
отрезков времени. Кроме того, одна и та
же реакция может в одних условиях,
например, при повышенных температурах,
протекать быстро, а в других, например,
при охлаждении - медленно, при этом
различие в скорости одной и той же
реакции может быть очень большим.
Скорость гомогенной реакции равна изменению концентрации любого из исходных веществ или продуктов реакции во времени. Различают среднюю и мгновенную скорости реакций.
Средняя скорость реакции:
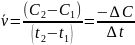
Мгновенная скорость реакции:
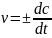
Константа скорости реакции — коэффициент пропорциональности в кинетическом уравнении.
Величина константы скорости k, зависит от природы реагирующих веществ, от температуры и от присутствия катализаторов, но не зависит от концентраций веществ.
Порядок
реакции — это показатель степени при
концентрации этого вещества в кинетическом
уравнении реакции.
Для многостадийных реакций порядки реакции по реагентам, как правило, не совпадают со стехиометрическими коэффициентами, а общий порядок реакции не равен сумме стехиометрических коэффициентов. В этом случае для расчёта скорости реакции используют кинетическое уравнение.
Наиболее
часто встречаются реакции первого,
второго и иногда третьего порядка.
Некоторые реакции имеют дробный порядок
(0.5, 1.5). Реакции более высокого порядка
чем третий не известны.
Итак, порядок простой (одностадийной) реакции равен сумме стехиометрических коэффициентов, а сложной (многостадийной) реакции ниже этой суммы.
Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация).
Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
Тримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трех частиц.
Реакции с молекулярностью более трёх неизвестны.
Для элементарных реакций, проводимых при близких концентрациях исходных веществ, величины молекулярности и порядка реакции совпадают. Чётко определенной взаимосвязи между понятиями молекулярности и порядка реакции нет, так как порядок реакции характеризует кинетическое уравнение реакции, а молекулярность — механизм реакции.
