
- •Детермінація поняття електронна спектроскопія.
- •Е/м спектр поглинання та його області. Діапазон спектру, що відповідає за електронні переходи. Зв'язок з іншими видами спектроскопії.
- •3. Енергія та частота електромагнітного випромінювання. Електронна, коливальна та обертальна складові енергії. Енергетичні підрівні.
- •Необхідність вивчення електронної спектроскопії. Її зв’язок з іншими дисциплінами.
- •5. Зв’язок з фізикою та хімією. Принцип Борна-Опенгеймера.
- •6. Фізична природа забарвлення речовини. Основні та додаткові кольори.
- •7. Природа уф та видимого спектру. «Вакуумний» ультрафіолетовий діапазон, особливості роботи в ньому.
- •8. Молекулярні орбіталі на прикладі етилену, бутадієну, формальдегіду. Зв’язуючі та антизв’язуючі мо. Взмо і нвмо. Довгохвильовий електронний перехід. Поняття про π-π та n-π переходи.
- •9. Залежність спектру поглинання хімічних речовин від різних факторів. Основні закони поглинання оптичного випромінювання: закон Бугера-Ламберта, закон Бера та обєднаний закон блб.
- •10. Інтенсивність поглинання та фактори, від яких залежить, момент переходу(дипольні моменти) заборонені переходи.
- •11. Крива спектру поглинання та її похідні (1, 2, 3, 4, математична обробка спектру)
- •13. Типи електронних переходів.
- •14. Спектри поглинання та люмінесценції
- •15. Спектри поглинання атомів та молекул.
- •16. Поняття про синглетний і триплетний стан.
15. Спектри поглинання атомів та молекул.
Оскільки електронна енергія атома квантова на, спектр поглинання, який виникає при окремому електронному переході, є лінійчатим.
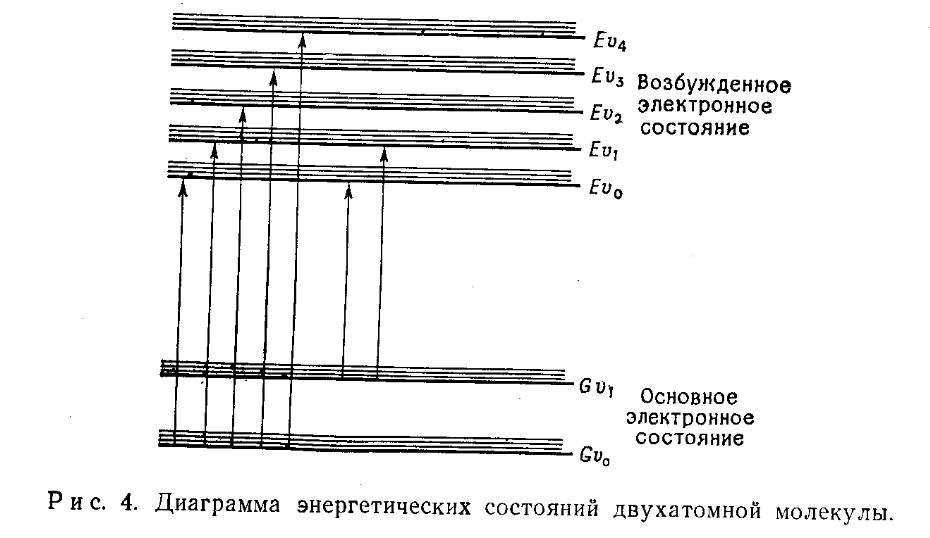
Для молекул такі лінії не спостерігаються, так як на електронні рівні накладаються обертальні та коливальні підрівні. Спекти простих молекул в газовій фазі являють собою ряд смуг, який складається з великої кількості вузьких ліній так званої обертальної структури, яка спостерігається лише при високій роздільній здатності. Кожна смуга отримується в результаті переходу молекули з даної комбінації коливальних і обертальних рівнів основного електронного стану на відповідну комбінацію рівнів у збудженому стані. Схематично це зображено на рисунку, на якому коливальні рівні позначені v0, v1, v2 і т.д. При звичайних температурах більшість молекул буде знаходитись на нульовому коливальному рівні (Gv0) основного електронного стану; відповідно, з цього рівня і відбуваються всі переходи. В більш складних молекулах з великою атомів велика кількість коливальних рівнів і близькість їх розташування приводять до того, що окремі смуги зливаються і отримується широка смуга поглинання.
16. Поняття про синглетний і триплетний стан.
На енергію електронного стану впливає сумарний спін електронів, і стан характеризується мультиплетністю. Результуючий електронний спін представляє векторну суму власних моментів кількості руху електронів:
S
= ![]()
а спінове квантове число S може або дорівнювати 0, або приймати напівцілі значення.
Спін орбітальна взаємодія, тобто зв’язок спіна з орбітальним моментом кількості руху електрона, може призводити до розчеплення електронного стану на 2S + 1компонентів. При S=0 мультиплетність дорівнює 1 і стан назавають синглетним, при S=1(мультиплетність дорівнює 3) стан називається триплетним.
