
- •Детермінація поняття електронна спектроскопія.
- •Е/м спектр поглинання та його області. Діапазон спектру, що відповідає за електронні переходи. Зв'язок з іншими видами спектроскопії.
- •3. Енергія та частота електромагнітного випромінювання. Електронна, коливальна та обертальна складові енергії. Енергетичні підрівні.
- •Необхідність вивчення електронної спектроскопії. Її зв’язок з іншими дисциплінами.
- •5. Зв’язок з фізикою та хімією. Принцип Борна-Опенгеймера.
- •6. Фізична природа забарвлення речовини. Основні та додаткові кольори.
- •7. Природа уф та видимого спектру. «Вакуумний» ультрафіолетовий діапазон, особливості роботи в ньому.
- •8. Молекулярні орбіталі на прикладі етилену, бутадієну, формальдегіду. Зв’язуючі та антизв’язуючі мо. Взмо і нвмо. Довгохвильовий електронний перехід. Поняття про π-π та n-π переходи.
- •9. Залежність спектру поглинання хімічних речовин від різних факторів. Основні закони поглинання оптичного випромінювання: закон Бугера-Ламберта, закон Бера та обєднаний закон блб.
- •10. Інтенсивність поглинання та фактори, від яких залежить, момент переходу(дипольні моменти) заборонені переходи.
- •11. Крива спектру поглинання та її похідні (1, 2, 3, 4, математична обробка спектру)
- •13. Типи електронних переходів.
- •14. Спектри поглинання та люмінесценції
- •15. Спектри поглинання атомів та молекул.
- •16. Поняття про синглетний і триплетний стан.
10. Інтенсивність поглинання та фактори, від яких залежить, момент переходу(дипольні моменти) заборонені переходи.
Інтенсивність поглинання характеризується коефіціентом поглина́ння — це відношення інтенсивності поглиненого випромінювання до випромінювання, що падає на поверхню. Прийняте позначення - α. Кефіцієнт поглинання вимірюється в обернених сантиметрах. Кефіцієнт поглинання може характеризувати затухання випромінювання будь-якого роду, наприклад, світла. При розпосюдженні світла в середовищі, енергія поглинута в тонкому шарі, пропорційна інтенсивності випромінювання I, яка падає на цей шар, і товщині шару dx. Таким чином інтенсивність при проходженні випромінювання крізь шар зменшується на величину
dI = − αIdx, Розв'язок даного рівняння записується у вигляді I(x) = I0e − αx,
де
I(x)
- інтенсивність випромінювання на
глибині x,
а I0
- інтенсивність випромінювання на
поверхні.
Коефіцієнт
поглинання залежить від частоти. Особливо
сильне поглинання на частотах, які
відповідають характерним частотам
процесів, що відбуваються в середовищі.
Правилами
відбору
в
спектроскопії
називають
обмеження
і
заборону
на
переходи
між
рівнями
квантомеханичних
системи
з
поглинанням
або
випромінюванням
фотона,
накладені законами
збереження
та
симетрією.
Дипольним
моментом
системи зарядів
qi
називається сума добутків величин
зарядів на їхні радіус-вектори.
![]() Матричний
елемент дипольного переходу визначається
як - <f|er|i>,
де |
i>
хвильова функція початкового стану
системи, а |
f >
- хвильова функція кінцевого стану
системи в позначеннях бра-та кет
-векторів, e - заряд електрона, а <r>
- радіус вектор.
За
аналогією
визначається
матричний
елемент
магніто-дипольного
переходу,
а
саме
-
<f
|µ(2s+L|
i>
де S-
оператор
спіна,
L
- оператор
орбітального
моменту.
Переходи
між
рівнями
називають
забороненими
переходами,
якщо
матричний
елемент
дипольного
переходу
дорівнює
нулю.
Незважаючи
на
назву,
заборонені переходи
можуть
відбуватися
за
рахунок
вищих
мультиплетних
моментів
або
при
наявність
третіх
тіл.
Їх
спектральна
інтенсивність
менше.
Матричний
елемент дипольного переходу визначається
як - <f|er|i>,
де |
i>
хвильова функція початкового стану
системи, а |
f >
- хвильова функція кінцевого стану
системи в позначеннях бра-та кет
-векторів, e - заряд електрона, а <r>
- радіус вектор.
За
аналогією
визначається
матричний
елемент
магніто-дипольного
переходу,
а
саме
-
<f
|µ(2s+L|
i>
де S-
оператор
спіна,
L
- оператор
орбітального
моменту.
Переходи
між
рівнями
називають
забороненими
переходами,
якщо
матричний
елемент
дипольного
переходу
дорівнює
нулю.
Незважаючи
на
назву,
заборонені переходи
можуть
відбуватися
за
рахунок
вищих
мультиплетних
моментів
або
при
наявність
третіх
тіл.
Їх
спектральна
інтенсивність
менше.
11. Крива спектру поглинання та її похідні (1, 2, 3, 4, математична обробка спектру)
Із теорії ел. спектрів відомо, що здатність орг. сполуки поглинати випромінювання визначається його ел. структурою.
наприклад,
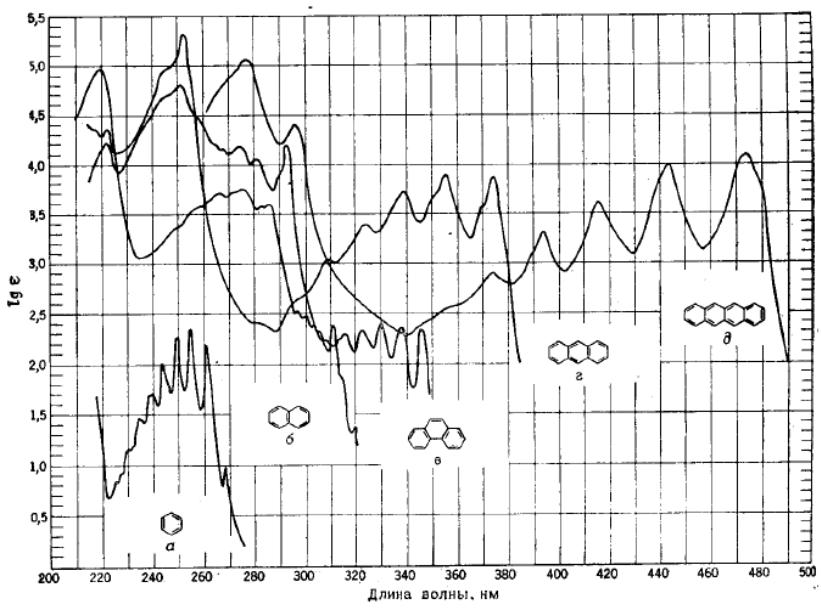
Рис.1. Електронні спектри поглинання бензолу, нафталіну, фенантрену, антрацену і нафтацену.
По мірі збільшення числа конденсованих кілець в ряду аром сполук поглинання зміщається в довгохвильову область.
Використання похідних є корисним методом для виявлення смуг, що перекриваються .
Перша похідна спектрів, як і всі похідні непарного порядку дуже важко інтерпретувати (окремі смуги спектра проявляються у вигляді перегинів) і тому вони рідко використовуються в спектроскопії. Друга похідна спектрів показує чіткі мінімуми для кожного плеча, присутнього ввихідному спектрії). Четверта похідна може бути навіть більш корисною для отримання інформації з контурівсмуг, але у випадку похідних високих порядків зростає рівень шуму, тому цей метод придатний тільки для спектрів з високим відношенням сигнал-шум.
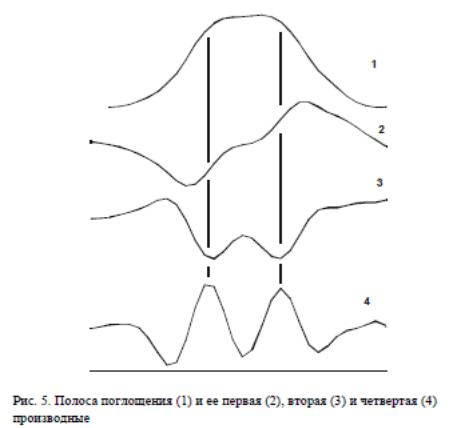
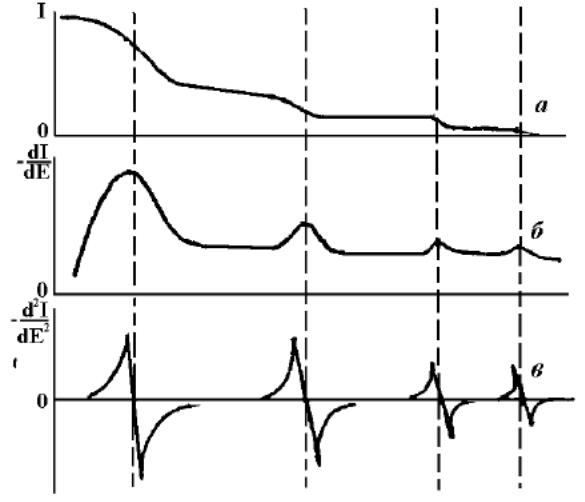
Оскільки спектри можуть перекриватися, то це може призводити до зниження чутливості визначення. Для поліпшення розділення смуг в спектрі поглинання розроблено декілька методів:
- метод чисельного диференціювання (спектроскопія похідних),
- Фур'є-перетворенняї,
-підбір спектрального профілю (аналіз кривої).
Перші два методи базуються на зміні перетворення Фур'є-інтерферограмми, шляхом множення, ділення її на коефіцієнти або зведення в ступінь її складових.
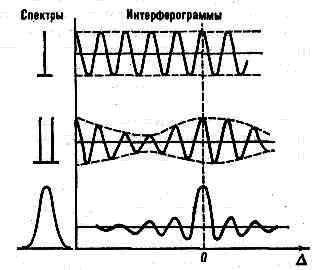
наприклад, інтерферограми, що відповідають спектр. лінії, спектр. дублетам, спектр. смузі.
Аналіз кривої заснований на її підгонці методом найменших квадратів. (представлятють зміну значення кожної частотної складової у вигляді окремої лінії на загальному графіку).
12. Практичні аспекти використання електронної спектроскопії. Використання ел. спектроскопії для ідентифікації хімічних речовин та аналізу двокомпонентних сумішей. Яскраві приклади використання в біології та медицині.
Електронна спектроскопія є дуже чутливим і зручним методом для визначення спектрів поглинання, пропускання і відбиття, вивчення кінетики реакції, що супроводжуються спектральними змінами. У звичайних умовах спектри мають дифузний характер, що обмежує їх застосування речовинами, що мають хромофорні групи (ароматичні цикли, кратні зв'язки і т.п.). Ці спектри дозволяють встановлювати наявність тих чи інших груп в молекулі, тобто здійснювати груповий аналіз, вивчати вплив замісників на електронні спектри і будову молекул, досліджувати таутомерію та інші перетворення.
Певні сполуки поглинають у відповідних діапазонах, наприклад, алкени з ізольованими подвійними зв'язками мають інтенсивну (ε від 6500 до 12000) широку смугу поглинання, обумовлену переходом π → π*, в області 165-200нм. Наявність алкільних заступників зсуває цю смугу в довгохвильову область.
електронна спектроскопія застосовується в багатьох теоретичних і прикладних областях науки і техніки.
Метод якісного аналізу органічних і металоорганічних сполук і матеріалів. Спільно з іншими методами аналізу в органічної хімії електронна спектроскопія використовується для встановлення та підтвердження будови речовини, ідентифікаці сполук. Перевагою цієї спектроскопії є те, що характеристичні групи можуть бути визначені в молекулах. За спектрами поглинання і емісії можна ідентифікувати хромофори молекули, такі як ароматичні і спряжені системи, а також ауксохроми, зв'язані з даним хромофором. В координаційній хімії можна оцінювати характер координації металу, геометрію координаційного центру.
Кількісний метод аналізу. Вимірюючи інтенсивність поглинання або випускання речовини в розчині, за електронними спектрами можна проводити кількісний аналіз вмісту певної сполуки в тій чи іншій суміші з достатньою точністю. На практиці це широко використовується для аналізу нафтопродуктів, геологічних зразків,медичних препаратів.
Електронна спектроскопія широко використовується для вивчення кінетики хімічних і фотохімічних реакцій. Оскільки електронні спектри пов'язані з переходом в збуджений стан молекули, який є набагато більш реакційно здатним, і навпаки, хімічні реакції протікають з утворенням збуджених станів, електронна спектроскопія дозволяє вивчати механізми і кінетику багатьох фотохімічних процесів.
У біології люмінесцентна спектроскопія використовується для візуалізації клітинних структур та вивчення клітинних процесів на молекулярному рівні. Для цього застосовуються люмінесцентні маркери, якими мітять ті чи інші клітинні структури або метаболіти.
У медицині використання специфічних люмінесцентних проб застосовується для люмінесцентного імуноаналізу.
Вивчення поглинання і випускання світла здійснюється для оцінки люмінесцентних матеріалів та їх використання в техніці, наприклад як органічні світлодіоди (OLED), сцинтилятори для детектування рентгенівського випромінювання, а також в інших сферах.
