
- •Детермінація поняття електронна спектроскопія.
- •Е/м спектр поглинання та його області. Діапазон спектру, що відповідає за електронні переходи. Зв'язок з іншими видами спектроскопії.
- •3. Енергія та частота електромагнітного випромінювання. Електронна, коливальна та обертальна складові енергії. Енергетичні підрівні.
- •Необхідність вивчення електронної спектроскопії. Її зв’язок з іншими дисциплінами.
- •5. Зв’язок з фізикою та хімією. Принцип Борна-Опенгеймера.
- •6. Фізична природа забарвлення речовини. Основні та додаткові кольори.
- •7. Природа уф та видимого спектру. «Вакуумний» ультрафіолетовий діапазон, особливості роботи в ньому.
- •8. Молекулярні орбіталі на прикладі етилену, бутадієну, формальдегіду. Зв’язуючі та антизв’язуючі мо. Взмо і нвмо. Довгохвильовий електронний перехід. Поняття про π-π та n-π переходи.
- •9. Залежність спектру поглинання хімічних речовин від різних факторів. Основні закони поглинання оптичного випромінювання: закон Бугера-Ламберта, закон Бера та обєднаний закон блб.
- •10. Інтенсивність поглинання та фактори, від яких залежить, момент переходу(дипольні моменти) заборонені переходи.
- •11. Крива спектру поглинання та її похідні (1, 2, 3, 4, математична обробка спектру)
- •13. Типи електронних переходів.
- •14. Спектри поглинання та люмінесценції
- •15. Спектри поглинання атомів та молекул.
- •16. Поняття про синглетний і триплетний стан.
Детермінація поняття електронна спектроскопія.
Електронна спектроскопія – сукупність методів аналізу властивостей сполук, які базуються на переходах між різними електронними станами атомів і молекул. Поглинання в області 1000-10 000 А обумовлюється зміною в електронному стані молекули. Відповідно до цього спектри поглинання в УФ і видимій областях отримали назву електронних. Електронні спектри багатоатомних молекул досліджуються зазвичай як спектри поглинання або люмінесценції. Перші виникають в результаті переходів з основного електронного стану в збудженні за рахунок поглинання квантів е/м випромінювання, а інші – в результаті переходу молекули із збудженого стану в основний з випромінюванням е/м випромінювання.
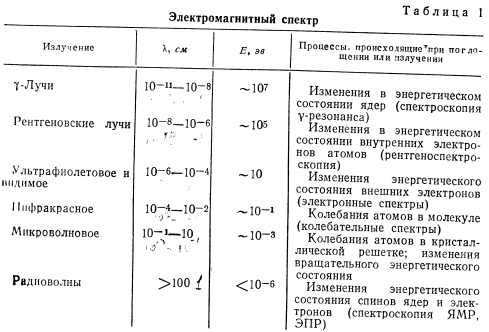
Молекула має квантовані енергетичні рівні, і її енергія складається з енергій електронного, коливального і обертального станів: Е=Еел + Екол + Еоб. Поглинання випромінювання викликає зміну в енергії цих станів, в результаті чого виникають електронні, коливальні і обертальні спектри. Обертальні спектри знаходяться в далекій ІЧ та мікрохвильовій областях. Коливальні спектри проявляються в середній і ближній ІЧ областях. Електронні спектри виникають в результаті переходів між електронними станами і виявляються в УФ, видимій і ближній ІЧ областях. Енергії переходів складають більше 100 ккал/моль. При поглинанні такої енергії одночасно відбувається зміна в коливальних і обертальних станах. Тому електронні спектри складаються з широких смуг, на яких іноді видно коливальну структуру.
Е/м спектр поглинання та його області. Діапазон спектру, що відповідає за електронні переходи. Зв'язок з іншими видами спектроскопії.
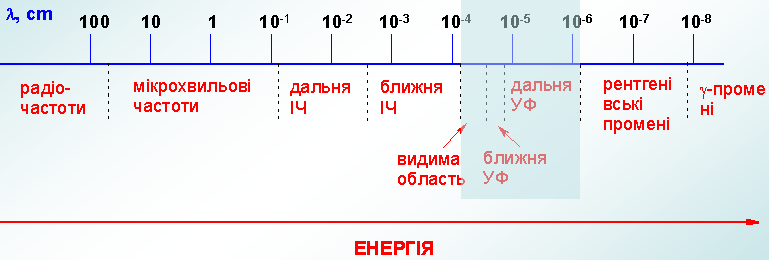
Серед багатьох фізичних методів дослідження, які застосовуються для дослідження будови органічних молекул, найбільший інтерес представляє взаємодія речовини з е/м випромінюванням в широкому інтервалі частот, починаючи з радіохвиль і закінчуючи гама-хвилями, тобто по всьому е/м спектру. При цьому відбувається зміна енергії молекул, яка визначається співвідношенням Бора: ∆Е=Екін-Епоч=hν. Якщо енергія кінцевого стану > енергії початкового стану, це відповідає поглинанню випромінювання і, навпаки, при Екін<Епоч відбувається випромінювання енергії. В першому випадку ми маємо справу зі спектрами поглинання, в другому – з емісійними спектрами.
Вся область е/м спектру не може бути досліджена за допомогою одного типу приладів. Експериментальні методи, які використовуються в спектроскопії, значно змінюються при переході від однієї області до іншої, але основні принципи залишаються незмінними. Щоб спостерігати спектри поглинання за будь-яких довжин хвиль необхідні наступні основні елементи:
Джерело випромінювання
Кювета зі зразком
Прилад, який дозволяє виділяти монохроматичне випромінювання
Приймач, за допомогою якого вимірюється інтенсивність випромінювання, яке пройшло через зразок
Реєструючий прилад.
3. Енергія та частота електромагнітного випромінювання. Електронна, коливальна та обертальна складові енергії. Енергетичні підрівні.
Атоми і молекули випромінюють енергію окремими порціями, або квантами, величина яких дорівнює Енергії електромагнітного випромінювання, що визначається за формулою:
E=hν, де h –стала Планка, у системі CI h= 6,62*10-34Дж · с
ν – частота (фізична величина, характеризує кількість подій за одиницю часу.)
ν=c/λ, с- швидкість світла; λ – довжина хвилі. Частота обернено пропорційна довжині хвилі.
Повна енергія молекули складається не тільки з електронної, але й енергії коливань ядер та енергії обертання молекули.
Тоді повна енергія молекули : Еповна=Ее+Еколив+Еобертальна,
Ee- енергія, обумовлена електронною конфігурацією;
Еколив - енергія, яка відповідає коливанням молекули (коливальна енергія);
Eобертальна - енергія, пов’язана з обертанням молекули (обертальна енергія).
Електрони в атомі розташовуються шарами – енергетичними рівнями. Кількість підрівнів дорівнює номеру рівня. Перший рівень містить один підрівень – 1s. Другий рівень містить два підрівні 2s2p. Третій рівень містить три підрівні– 3s3p3d. Четвертий рівень чотири підрівні – 4s4p4d4f.
