
- •Детермінація поняття електронна спектроскопія.
- •Е/м спектр поглинання та його області. Діапазон спектру, що відповідає за електронні переходи. Зв'язок з іншими видами спектроскопії.
- •3. Енергія та частота електромагнітного випромінювання. Електронна, коливальна та обертальна складові енергії. Енергетичні підрівні.
- •Необхідність вивчення електронної спектроскопії. Її зв’язок з іншими дисциплінами.
- •5. Зв’язок з фізикою та хімією. Принцип Борна-Опенгеймера.
- •6. Фізична природа забарвлення речовини. Основні та додаткові кольори.
- •7. Природа уф та видимого спектру. «Вакуумний» ультрафіолетовий діапазон, особливості роботи в ньому.
- •8. Молекулярні орбіталі на прикладі етилену, бутадієну, формальдегіду. Зв’язуючі та антизв’язуючі мо. Взмо і нвмо. Довгохвильовий електронний перехід. Поняття про π-π та n-π переходи.
- •9. Залежність спектру поглинання хімічних речовин від різних факторів. Основні закони поглинання оптичного випромінювання: закон Бугера-Ламберта, закон Бера та обєднаний закон блб.
- •10. Інтенсивність поглинання та фактори, від яких залежить, момент переходу(дипольні моменти) заборонені переходи.
- •11. Крива спектру поглинання та її похідні (1, 2, 3, 4, математична обробка спектру)
- •13. Типи електронних переходів.
- •14. Спектри поглинання та люмінесценції
- •15. Спектри поглинання атомів та молекул.
- •16. Поняття про синглетний і триплетний стан.
13. Типи електронних переходів.
Перехід молекули з одного електронного стану в інший супроводжується перерозподілом електронної густини. Існують певні закономірності в спектрах поглинання, що відповідають змінам в електронному стані молекули. Електрони, у відповідності з їх участю в утворенні зв’язку, позначаються як σ-, π- та n-електрони. Хвильові функції σ-електронів симетричні відносно осі зв’язку, хвильові функції π-електронів – антисиметричні. Зв’язуючі орбіталі позначаються σ і π, розрихляючі – σ* і π*. Незв’язуючі (ті, що не беруть участь в утворенні зв’язку) n-електрони – це електрони неподілених пар гетероатомів, а також електрони внутрішніх оболонок, що належать одному атому. Електронні переходи в припущенні, що змінюється стан одного електрона, позначаються орбіталями початкового і кінцевого станів електронів: σ → σ*, π → π*, n → n*, n → σ*, або коротко nπ*, nσ*, ππ*, σσ*. Часто переходи позначаються в тому порядку орбіталей, як вони записуються в матричному елементі переходу: спочатку кінцевий стан, потім – початковий, і стрілка направляється справа наліво (σ ← σ*, π*← n). Такі позначення переходу справедливі тільки для двохатомних груп, включаючи один зв’язок між двома ядрами.
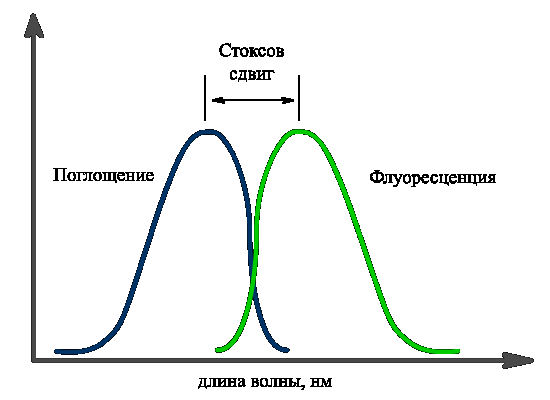
14. Спектри поглинання та люмінесценції
Люмінесценція – випускання фотонів із електронно-збуджених станів (нетеплове свічення речовини, яке відбувається після поглинання нею енергії збудження) – ділиться на два типи залежно від природи основного та збудженого станів. У синглетному збудженому стані електрон на енергетично вищій орбіталі та другий електрон на орбіталі з нижчою енергією мають протилежну орієнтацію спінів (спіни цих електронів спарені). У триплетному стані ці електрони не спарені, тобто їх спіни мають однакову орієнтацію. При поверненні електрона із збудженого синглетного стану в основний орієнтація його спіну не повинна змінюватися. Зміна орієнтації спіну необхідна при переході із триплетного стану в синглетний основний стан. Флуоресценція – це випускання, яке відбувається при поверненні спареного електрону на більш низьку орбіталь. Такі переходи «квантовомеханічнодозволені». Фосфоресценція – це випускання, яке відбувається при переході між станами різної мультиплетності, як правило із збудженого триплетного стану в синглетний основний. Такі переходи не дозволені.
Фізична природа люмінесценції полягає у випромінювальних переходах електронів атомів або молекул із збудженого стану в основний. При цьому причиною їх першопочаткового збудження можуть бути різні фактори: зовнішнє випромінювання, температура, хімічні реакції та ін.
Спектром поглинання називають залежність інтенсивності поглинання від довжини хвилі, тоді як спектром люмінесценції - залежність інтенсивності люмінесценції від довжини хвилі. Як правило, спектр люмінесценції зсунутий відносно спектру поглинання в сторону більших довжин хвиль (правило Стокса-Ломмеля). Це пояснюється втратою деякої частини поглинутої енергії на тепловий рух молекул.
Спектри поглинання та люмінесценції в координатах частоти є взаємним дзеркальним відображенням (правило дзеркальної симетрії Левшина). Положення осі симетрії показує енергію чисто електронного переходу.
