
- •Введение
- •Общие методические указания
- •Темы рефератов
- •Естественнонаучная и гуманитарная культуры Путь к единой культуре
- •Краткий очерк истории естествознания
- •Иерархия объектов в природе
- •Физические поля в природе
- •Фундаментальные взаимодействие в природе
- •Основные понятия и законы современного естествознания
- •Классическая механика.
- •Квантовая механика
- •Квантование. Принцип Паули.
- •Происхождение химических элементов
- •Релятивистская механика.
- •Статистическая механика
- •Системы с большим числом частиц
- •Динамические и статистические закономерности
- •Замкнутые многочастичные системы
- •Устойчивость систем
- •Нелинейные динамические системы
- •Биосфера
- •Механизмы и закономерности эволюции живой природы
- •Биомолекулы
- •Пространственная модель молекулы днк
- •Проблема жизни в естествознании
- •История эволюционных идей
- •Современные представления об эволюции
- •Направленность и ограниченность эволюционного процесса
- •Содержание
Замкнутые многочастичные системы
Изолированной, или замкнутой системой назовем конечную область пространства, заполненную частицами, которые не могут обмениваться энергией с окружающими телами. Граница системы может быть как материальной (стенки сосуда), так и воображаемой, и представлять собой ту часть пространства, в которой происходит переход от свойств системы к свойствам внешней среды.
Свойства самой
системы могут быть описаны несколькими
величинами, которые называют параметрами
системы. Например, состояние некоторой
массы идеального газа полностью
характеризуется тремя параметрами,
давлением – Р, концентрацией частиц –
n, температурой – Т. Соотношение между
параметрами состояния системы называют
уравнением состояния. Уравнение состояния
идеального газа имеет вид: Р= n·k·Τ,
где k = 1,38·10![]()
![]() - постоянная Больцмана. Это уравнение
хорошо выполняется в широком диапазоне
значений параметров идеального газа.
Уравнения вещества в жидком состоянии
ещё не известно. Параметры, характеризующие
состояние системы как единого целого,
определяют, проводя опыты со всей
системой. Если же измерять параметры
небольших выделенных объёмов системы,
то легко заметить, что вследствие
непрекращающегося движения частиц, они
хаотически меняются. Отклонение значений
параметров частей системы от значений
соответствующих параметров усредненных
по всей системе называют флуктуациями.
- постоянная Больцмана. Это уравнение
хорошо выполняется в широком диапазоне
значений параметров идеального газа.
Уравнения вещества в жидком состоянии
ещё не известно. Параметры, характеризующие
состояние системы как единого целого,
определяют, проводя опыты со всей
системой. Если же измерять параметры
небольших выделенных объёмов системы,
то легко заметить, что вследствие
непрекращающегося движения частиц, они
хаотически меняются. Отклонение значений
параметров частей системы от значений
соответствующих параметров усредненных
по всей системе называют флуктуациями.
Например:
В баллоне объемом 20 см![]()
![]() находится
8000 молекул воздуха, значит в одном
кубическом сантиметре должно находиться
400 молекул. Однако, вследствие хаотического
движения, число молекул в каждом, отдельно
взятом кубике будет меняться. Возможное
отклонение, или флуктуация, будет порядка
находится
8000 молекул воздуха, значит в одном
кубическом сантиметре должно находиться
400 молекул. Однако, вследствие хаотического
движения, число молекул в каждом, отдельно
взятом кубике будет меняться. Возможное
отклонение, или флуктуация, будет порядка
![]() ,
в нашем случае число частиц может быть
от 380 до 420. Т.о., чем больше (по числу
частиц) и сложнее макроскопическое
тело, тем меньше относительная флуктуация.
,
в нашем случае число частиц может быть
от 380 до 420. Т.о., чем больше (по числу
частиц) и сложнее макроскопическое
тело, тем меньше относительная флуктуация.
На ЭВМ ставился
«теоретический эксперимент» с моделью
макроскопической системы. В качестве
модели брался ящик с несколькими сотнями
упруго сталкивающихся шаров и условно
разделенным на равные левую и правую
части. Как же «молекулы» распределялись
по обеим половинам? Число возможных
способов распределения одной молекулы
в ящике равно двум (или в левой половине
или в правой). Значит, вероятность
обнаружить эту молекулу в левой половине
равна
![]() , число распределений двух пронумерованных
молекул будет равно
, число распределений двух пронумерованных
молекул будет равно
![]() ,
а вероятность обнаружить обе молекулы
в левой половине ящика равно
,
а вероятность обнаружить обе молекулы
в левой половине ящика равно
![]() .
В случае нахождения в ящике N
молекул полное число возможных различных
распределений по обеим половинкам
ящика равно
.
В случае нахождения в ящике N
молекул полное число возможных различных
распределений по обеим половинкам
ящика равно
![]() , а вероятность нахождения всех молекул
в левой половине ящика
, а вероятность нахождения всех молекул
в левой половине ящика
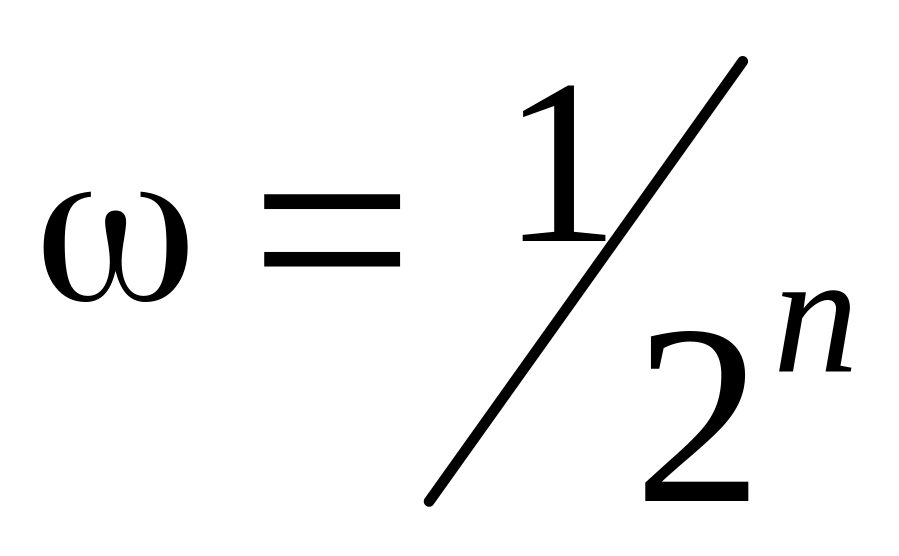 .
При N=80
.
При N=80![]() число
возможных состояний
число
возможных состояний
![]() .
Если предположить , что за одну секунду
реализуется
.
Если предположить , что за одну секунду
реализуется
![]() состояний то, чтобы все 80 молекул
собрались в одной левой половине ящика
надо «подождать» 10 миллиардов лет.
состояний то, чтобы все 80 молекул
собрались в одной левой половине ящика
надо «подождать» 10 миллиардов лет.
Полученный результат «теоретического эксперимента» показывает, что упорядоченное состояние системы (все молекулы находятся в одной, определенной части сосуда) чрезвычайно маловероятное состояние.
Анализ явлений природы, результаты практических экспериментов показывают, что процессы идущие в макротелах необратимы во времени. Наиболее вероятное состояние системы с большим числом частиц такое, при котором частицы равномерно распределены по равным объёмам системы, это соответствует наибольшему числу возможных способов распределения частиц по их микросостояниям. Такое состояние системы называют статистическим равновесием. В нем система может находиться «неограниченно долго».
Обозначив число микросостояний, в которых реализуется данное макросостояние, системы Γ, введем понятие энтропии Ѕ, как величины прямо пропоциональной натуральному логарифму Г, т.е.,
![]() ,
где k
=1,38
,
где k
=1,38![]() (*)
(*)
Формула (*) позволяет дать энтропии S наглядное толкование, применимое к любым статистическим системам. Допустим, что все частицы некоторой системы закреплены в определенных местах, т. е., осуществлено только одно микросостояние. Энтропия, соответствующая этому состоянию равна нулю.
![]()
Чем больше число микросостояний системы, тем более она разупорядочена, тем больше в системе беспорядка. Поэтому можно сказать, что энтропия - это величина, характеризующая меру беспорядка. Состояние равновесия есть наиболее вероятное состояние, оно осуществляется наибольшим числом микросостояний, поэтому в состоянии равновесия энтропия системы максимальна. Если замкнутая система в некоторый момент времени не находится в состоянии равновесия, то в следующие моменты времени в ней начинают происходить процессы перехода в более вероятное состояние. Другими словами, в изолированной системе процессы всегда происходят в направлении возрастания энтропии. Точнее, во всех замкнутых системах энтропия не убывает, она либо постоянна, либо возрастает. Это утверждение носит название закона возрастания энтропии.
В неизолированных системах энтропия может и возрастать и убывать, в зависимости от характера процессов взаимодействии системы с окружающей средой.
