
Далее теория со следующей страницы. Технология производства минеральных удобрений
Минеральные удобрения являются одним из важнейших для народного хозяйства видов продукции химической промышленности. Задача расширенного производства продуктов питания решается применением минеральных удобрений. Научными прогнозами и перспективными планами предусматривается дальнейшее увеличение мирового выпуска минеральных, органоминеральных и удобрений с регулируемым сроком действия. В мире производится до 100-150 млн. т. удобрений. 1/3 населения Земли питается за счет урожая, выращенного за счет химических удобрений. 80-90% всех минеральных удобрений расходуется в Европе, Японии и Северной Америке. Остальные 2/3 человечества – 10-20% мировой продукции. На 1 га в сельском хозяйстве в развитых странах вносится более 100 кг азота, в Африке < 1 кг.
Науке известно, что в состав растений входят 70 химических элементов, 16 из них особенно важны для жизни растений. Минеральные удобрения – это соли, содержащие в своем составе элементы (N2, P, K), необходимые для питания, развития и роста растений и вносимые в почву для получения высоких и устойчивых урожаев. Доля концентрированных удобрений в мировом производстве в 80-ые годы – до 80%. Самым дешевым концентратом азота является безводный аммиак. Его легко вносить в почву в виде водного раствора.
Аммиак летуч, имеет неприятный запах, способствует коррозии металла, более перспективно употреблять жидкие азотные удобрения в виде гомогенной системы, содержащей 35% карбамида и 41% аммиачной селитры (КАС).
Использование этих удобрений по сравнению с твердыми формами позволяет в 2-3 раза увеличить производительность труда при транспортировке, хранении и внесении их в почву. В стране выпускают все известные минеральные удобрения (160 видов), кормовые добавки для животноводства и химические средства защиты растений.
Азотные удобрения пересчитывают на 20,5% N
Фосфорные на 18,7% P2O5 усвояемой
Калийные на 41,6% K2O
Борные на 9%H3BO3
До 50% азота и 30% фосфора теряются, не дойдя до растений. Альтернативы применения минеральных удобрений – это использование регуляторов роста растений и структурообразователей почвы.Обеспеченность страны новыми удобрениями (жидкими минеральными, бесхлорными калийными, пролонгированного действия, с микроэлементами) составляет 10%.
Сырьевая база
В России на Кольском полуострове- апатиты Ca5F(PO4)3.
В Казахстане в бассейне Кара-Тау-фосфориты Ca3(PO4)2.
Калийные удобрения (Березники, Соликамск) составляют 24 млрд. т из 71 млрд. т. в мире. Удобрения состоят из сильвинита, каинита - MgSO4, KCl*3H2O, карналлита NaCl, KCl, MgCl2*6H2O. Перспективным ассортиментом является использование калия в составе сложных удобрений и использование не хлорных форм калия.
Минеральные удобрения классифицируют по их агрохимическому значению, количеству и виду питательных веществ, растворимости в почвенных водах, физиологическому действию на удобрения почвы.
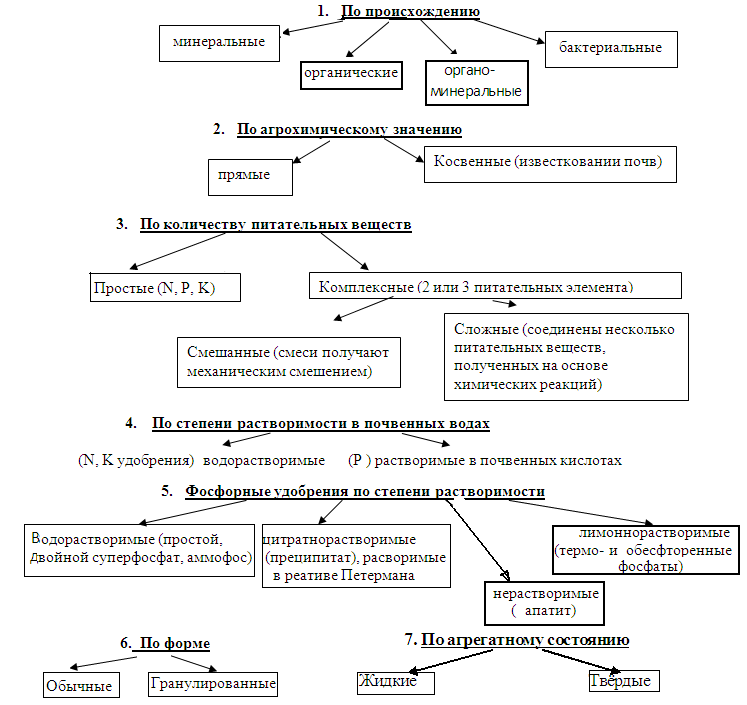

Важнейшие минеральные удобрения
Название удобрений |
Главные компоненты |
Содержание питательных веществ |
Суперфосфат |
Ca(H2PO4)2*H2O + H3PO4 + CaSO4 |
14 - 21% P2O5 |
Двойной суперфосфат |
Ca(H2PO4)2*H2O + H3PO4 |
38 - 52% P2O5 |
Преципитат |
CaHPO4*2H2O |
27 - 40% P2O5 |
Обесфторенный фосфат |
3CaO*P2O5 + 4CaO*P2O5 Ca3(PO4)2 + Ca4P2O9 |
20 - 38% P2O5 |
Аммиак жидкий |
NH3 |
82,3% N |
Аммиачная селитра |
NH4NO3 |
34 - 35 % N |
Карбамид |
CO(NH2)2 |
46 % N |
Карбамидоформальдегидные |
H-NHCO-NHCH2 |
33 - 42 % N |
Хлористый калий |
KCl |
50 - 62% K2O |
Сульфат калия |
K2SO4 |
48 - 52 % K2O |
Калимагнезия |
K2SO4*MgSO4 |
28 % K2O |
Аммофос P2O5вод 90% |
NH4H2PO4 + (NH4)2HPO4 |
11 – 14% N, 48 – 52% P2O5 |
Диаммофос P2O5вод 90% |
(NH4)2HPO4 + NH4H2PO4 |
16 – 18% N, 46 – 48% P2O5 |
Азофос |
NH4NO3 + NH4H2PO4 + CaHPO4 |
22% N, 22% P2O5 |
Нитрофос P2O5вод 45% |
NH4NO3 + NH4H2PO4 + CaHPO4 |
23,5% N, 18% P2O5 |
Нитрофоска P2O5вод 55% |
NH4NO3 + NH4H2PO4 + CaHPO4 + KNO3 + NH4Cl |
11% N, 11% P2O5, 11% K2O |
Азофоска P2O5вод 85% |
|
16% N, 16% P2O5, 16% K2O |
Нитрофоска азотно-сульфатная |
NH4NO3 + NH4H2PO4 + CaHPO4 + CaSO4*2H2O + KNO3 + NH4Cl |
11% N, 11% P2O5, 11% K2O |
Нитрофоска карбонатная |
NH4NO3 + CaHPO4 + CaCO3 + KNO3 + NH4Cl |
13% N, 13% P2O5, 13 % K2O |
Нитроаммофос P2O5вод 95% |
NH4NO3 + NH4H2PO4 |
22% N, 22% P2O5 |
Нитроаммофоска P2O5вод 90% |
NH4NO3 + NH4H2PO4 + KNO3 + NH4Cl |
17% N, 17% P2O5, 17% K2O |
Калиевая селитра |
KNO3 |
13% N, 46,5% K2O |
Производство простого суперфосфата Простой гранулированный суперфосфат — дешевое фосфорное удобрение. Однако он имеет существенный недостаток — низкое содержание основного компонента (19—21% усвояемого Р2О5) и высокую долю балласта — сульфата кальция. Его производят, как правило, в районах потребления удобрений, так как экономичнее доставлять концентрированное фосфатное сырье к суперфосфатным заводам, чем перевозить на дальние расстояния низко концентрированный простой суперфосфат. Сущность производства простого суперфосфата состоит в превращении природного фторапатита,
нерастворимого в воде и почвенных растворах, в растворимые соединения, преимущественно в монокальцийфосфат Са(Н2РО4)2. Процесс разложения может быть представлен следующим суммарным уравнением:
2Ca5F(PO4)3+7H2SO4+3H2O=3Са(Н2РО4)2*Н2О]+ 7[CaSO4 *0,5H2O]+2HF;
ΔН=227,4кДж (1)
Практически в процессе производства простого суперфосфата разложение протекает в две
стадии. На первой стадии около 70% апатита реагирует с серной кислотой. При этом образуются фосфорная кислота и полугидрат сульфата кальция:
Ca5F(PO4)3+5H2SO4 +2,5H2O = 5 (CaSO40,5H2O) +3H3PO4 +HF (2)
Эта стадия представляет собой химическое растворение, осложненное осаждением на зернах фосфата плотных, или сравнительно рыхлых пористых корок сульфата кальция. Плотные корки сильно затрудняют диффузию жидкой фазы к поверхности фосфата и поэтому реакция замедляется; рыхлые корки замедляют реакцию в меньшей степени. Структура образующейся корки обусловлена скоростью кристаллизации твердой фазы, зависящей главным образом от пересыщения раствора сульфатом кальция, которое определяется в свою очередь концентрацией серной кислоты, температурой и другими факторами.
Выкристаллизовавшиеся микрокристаллы сульфата кальция образуют структурную сетку,
удерживающую большое количество жидкой фазы, и суперфосфатная масса затвердевает
(схватывается). Первая стадия процесса разложения начинается сразу после смешения реагентов и заканчивается в течение 20—40 мин в суперфосфатных камерах.
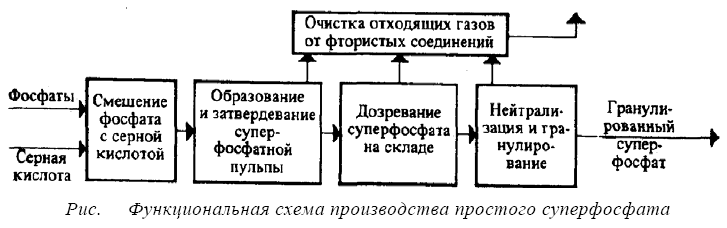
После полного израсходования серной кислоты начинается вторая стадия разложения, в которой оставшийся апатит (30%) разлагается фосфорной кислотой. Образующийся монокальцийфосфат в отличие от сульфата кальция не сразу выпадает в осадок. Он постепенно насыщает раствор фосфорной кислоты, после чего начинает выкристаллизовываться в виде Са(Н2РО4)2 • Н2О. Реакция (2) протекает значительно медленнее, чем реакция (1), что объясняется низкой активностью фосфорной кислоты и кристаллизацией твердых фаз. Она начинается в суперфосфатных камерах и длится еще в течение 5—20 сут . хранения суперфосфата на складе. После дозревания на складе разложение фторапатита считают практически законченным, хотя в суперфосфате еще остается небольшое количество неразложившегося фосфата и свободной фосфорной кислоты. Функциональная схема получения простого суперфосфата представлена на рис.
Основные процессы проходят на первых трех стадиях: смешения сырья, образования и затвердевания
суперфосфатной пульпы, дозревания суперфосфата на складе.
Для обеспечения высокой скорости гетерогенного процесса сернокислотного разложения
фосфатов используют ряд технологических приемов:
1. Серную кислоту для разложения фосфатов берут в небольшом избытке (в 1,07—1,14 раза
больше стехиометрического количества).
2. Используют 68,5—69,5%-ную серную кислоту.
3. Температуру в суперфосфатной камере поддерживают на уровне 115—120°С, что
обеспечивает достаточную скорость разложения и в то же время позволяет получить продукт
(суперфосфат), обладающий хорошими физическими свойствами.
Для получения товарного продукта более высокого качества суперфосфат после дозревания
подвергают нейтрализации твердыми добавками (известняком, фосфоритной мукой и т. п.) и
гранулируют.
На рис. изображена технологическая схема получения простого суперфосфата
непрерывным способом с использованием кольцевой вращающейся камеры. Серную кислоту,
подогретую до 55—65°С, из напорного бака 4 направляют в кислотный смеситель 2, где разбавляют
водой до образования 68-68,5%-ной H2SO4. Через щелевой расходомер 3 серную кислоту непрерывно подают в смеситель 25, где в течение нескольких минут смешивают с апатитовым концентратом,
подаваемым из бункера через весовой дозатор 26. Образующаяся при смешении густая сметанообразная пульпа при температуре 110—115°С непрерывно поступает в суперфосфатную
камеру 24. Здесь продолжается начавшаяся в смесителе реакция разложения фосфата серной кислотой.
После затвердевания суперфосфатную массу вырезают ножами фрезера 22. Срезанный суперфосфат
через центральную (разгрузочную) трубу 23 удаляют из камеры и ленточным транспортером 21 подают на склад. С транспортера суперфосфат попадает на разбрасыватель 20, разбивающий комки
суперфосфата. При этом часть влаги испаряется и суперфосфат охлаждается.
Отходящие из камеры фторсодержащие газы поступают на очистку в абсорбционные камеры,
орошаемые водой или разбавленной кремнефтористоводородной кислотой. При циркуляции в
камерах получается 8—10%-ный раствор H2SiF6, который отводят на переработку.
Суперфосфат выдерживают в течение 5—20 сут. на складах, где он хранится в кучах высотой 6—10 м.
В течение этого времени с помощью грейферного крана 19 суперфосфат 2—3 раза перелопачивают
Вызревший суперфосфат смешивают с сухим известняком для нейтрализации, отсеивают от
крупных частиц на грохоте 8 и измельчают в валковой дробилке 9. Затем в барабанном грануляторе 17
порошкообразный суперфосфат смешивают с ретуром , увлажняют и при вращении барабана окатывают в гранулы округлой формы.
Влажные гранулы сушат в барабанной сушилке 16 топочными газами. Высушенный продукт
классифицируют на виброгрохоте 12. Фракция гранул размером 1—4 мм является товарным продуктом.
Его охлаждают воздухом в аппарате 14 с псевдоожиженным слоем твердой фазы и подают на
затаривание. Мелкую фракцию вновь направляют на грануляцию, а крупную измельчают в дробилке 15 и возвращают элеватором на грохот.
Простой гранулированный суперфосфат — дешевое фосфорное удобрение. Однако он имеет
существенный недостаток — низкое содержание основного компонента (19—21% усвояемого Р2О5) и
высокую долю балласта — сульфата кальция. Его производят, как правило, в районах потребления
удобрений, так как экономичнее доставлять концентрированное фосфатное сырье к суперфосфатным
заводам, чем перевозить на дальние расстояния низкоконцентрированный простой суперфосфат.Получить концентрированное фосфорное удобрение можно, заменив серную кислоту при
разложении фосфатного сырья на фосфорную. На этом принципе основано производство двойного
суперфосфата.

Производство двойного суперфосфата
Двойной суперфосфат — концентрированное фосфорное удобрение, получаемое разложением природных фосфатов фосфорной кислотой. Фторапатит 3 Ca3(PO4)2*CaF2 записывается в виде Ca5F(PO4)3.
Он содержит 42—50% усвояемого Р2О5, в том числе в водорастворимой форме 27—42% Р2О5 т.е. в 2 -3 раза больше, чем простой.
По внешнему виду и фазовому составу двойной суперфосфат похож на простой
суперфосфат. Однако он почти не содержит балласта — сульфата кальция.
При разложении природных фосфатов фосфорной кислотой протекает реакция, совпадающая со второй стадией производства простого суперфосфата.
Фосфорную кислоту для проведения этой реакции предварительно получают
также из фосфатного сырья, например путем его разложения концентрированной
серной кислотой (экстракционная фосфорная кислота), либо путем высокотемпературного восстановления элементного фосфора с последующим его окислением и гидратацией (термическая фосфорная кислота).
Двойной суперфосфат можно получать по технологической схеме, аналогичной схеме получения простого суперфосфата.
Такой метод получения двойного суперфосфата называется камерным. Его недостатками являются длительное складское дозревание продукта, сопровождающееся неорганизованными выделениями вредных соединений фтора в атмосферу, и необходимость применения концентрированной фосфорной кислоты. Получение двойного суперфосфата камерным способом:
Ca5F(PO4)3 + 7 H3PO4 + 5 H2O = 5 CaH2PO4*H2O + HF + Q
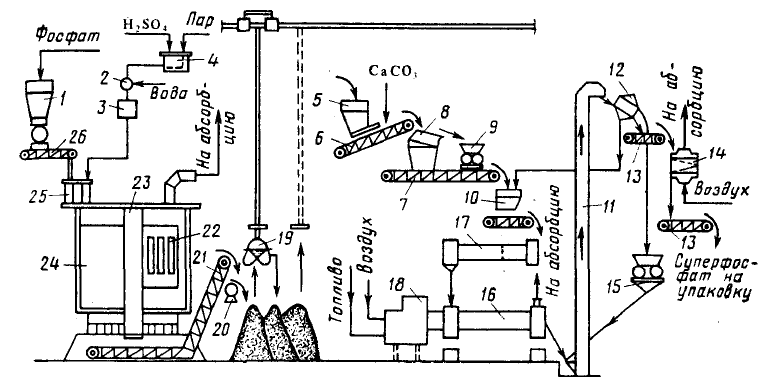
Более прогрессивным и экологичным является поточный метод производства двойного суперфосфата. В нем используют для разложения сырья более дешевую не упаренную фосфорную кислоту. Метод является полностью непрерывным (отсутствует стадия длительного складского дозревания продукта).
Технологическая схема поточного метода производства гранулированного двойного суперфосфатаиз фосфоритной муки и не упаренной экстракционной фосфорной кислоты показана на рис.
В реакторы 4 подают фосфоритную муку и фосфорную кислоту. В течение ~ I ч при 70—90°С происходит разложение фосфоритов на 55-60%.
Вытекающую из реакторов пульпу разделяют на два потока. Часть ее (около половины) высушивают топочными газами в распылительной сушилке.
Высушенный мелкозернистый материал подвергают гранулированию. Для этого его смешивают в шнековом смесителе-грануляторе 8 со второй частью пульпы.
Сюда же подают небольшое количество ретура (ретуром называют часть готового продукта, не удовлетворяющего техническим требованиям на него – например,
состоящего из гранул большего или меньшего размера, чем требуемый, – и
возвращаемый в процесс). Затем гранулы, содержащие 20—22% влаги, высушивают в прямоточной барабанной сушилке до влажности 3—4%. В процессе сушки разложение исходного сырья продолжается , общая степень разложения сырья увеличивается 80 -90%.
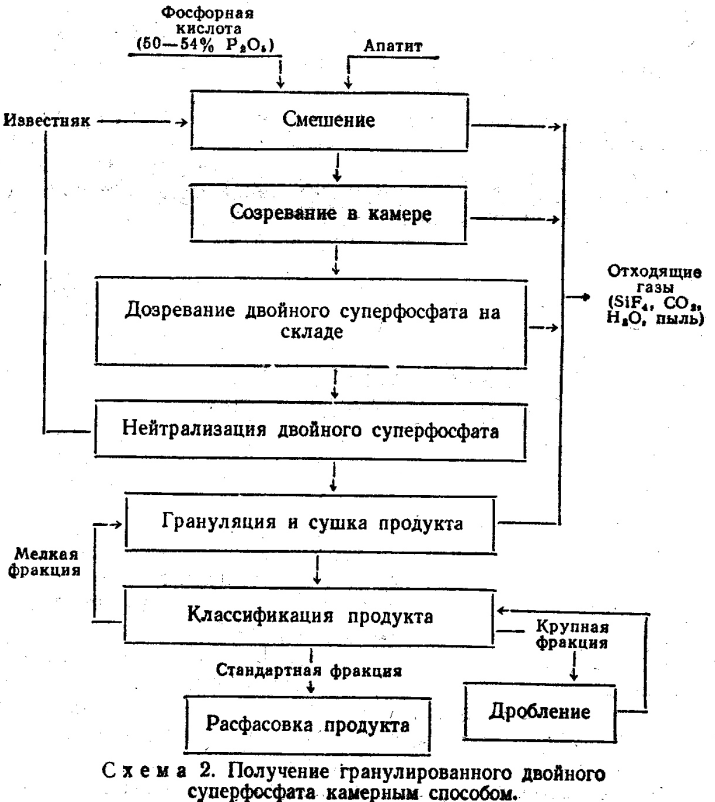
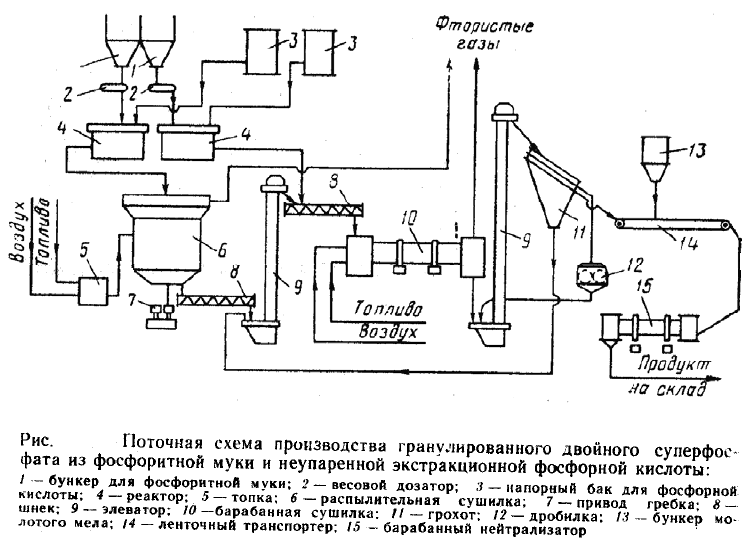
Продукт, выходящий из барабанной сушилки, направляют на грохочение. Гранулы размерами от 1 до 4 мм нейтрализуют мелом в барабанном нейтрализаторе 15. Частицы крупнее 4 мм измельчают в дробилке, смешивают с мелочью (менее 1 мм) и возвращают в смеситель-гранулятор в качестве ретура.
Простой и двойной суперфосфаты содержат Р2О5 в легко усваиваемой растениями форме. Однако в последние годы больше внимания стало уделяться выпуску удобрений
с регулируемым сроком действия, в частности долговременно действующих.
Для получения таких удобрений можно покрыть гранулы суперфосфата оболочкой, регулирующей высвобождение питательных веществ. Другой путь— смешение двойного суперфосфата с фосфоритной мукой. Например, таким долговременно действующим фосфатным удобрением является суперфос.
Это удобрение содержит 37—38% Р2О5, в том числе около половины в быстродействующей водорастворимой форме и около половины — в медленнодействующей. Применение такого удобрения удлиняет срок его эффективного действия в почве.
