
- •Закон сохранения массы веществ (м.В.Ломоносов, 1748 г.; а.Лавуазье, 1789 г.)
- •2. Оксиды: классификация, составление формул, номенклатура, химические свойства, способы получения. Оксиды.
- •Получение.
- •Получение.
- •8. Строение атома. Квантовая механика и ее подход к описанию состояния электрона в атоме. Квантовые числа и их физический смысл. Троение атома
- •Ряд электроотрицательностей
- •Ковалентная связь.
- •12. Свойства ковалентной связи. Валентные возможности атомов. Гибридизация атомных орбиталей (основные типы гибридизации с примерами). Геометрия молекул. Свойства ковалентной связи
- •13. Ионная связь. Механизм образования ионной связи. Отличия ионной связи от ковалентной.
- •20. Малорастворимые электролиты. Произведение растворимости.
- •21. Ионное произведение воды, водородный показатель рН. Вода является очень слабым электролитом: лишь незначительная часть молекул воды диссоциирует на ионы:
20. Малорастворимые электролиты. Произведение растворимости.
Произведение растворимости (ПР, Ksp) — произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:
![]()
Константа этого равновесия рассчитывается по уравнению:
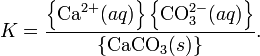
В приближении идеального раствора с учетом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:
![]()
Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m ионов An+ и n ионов Bm-, рассчитывается по уравнению:
![]()
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
21. Ионное произведение воды, водородный показатель рН. Вода является очень слабым электролитом: лишь незначительная часть молекул воды диссоциирует на ионы:
H2O ↔ H+ + OH¯
Экспериментально установлено, что произведение концентраций ионов H+ и OH¯ в воде и разбавленных водных растворах электролитов является величиной постоянной и называется ионным произведением воды (Kw)
Kw = [H+] + [OH¯] = 10-14,
[H+] = [OH¯] = 10-7 моль/л
Для удобства условились выражать кислотность раствора как отрицательный логарифм концентрации водородных ионов. Эту величину называют водородным показателем и обозначают pH.
pH = -lg[H+]
Аналогично, отрицательный логарифм концентрации гидроксильных ионов обозначают pOH, однако, пользуются этим показателем значительно реже.
pH + pOH = 14
В зависимости от соотношения концентраций ионов H+ и OH¯ различают три вида реакции среды:
кислая среда: [H+] > [OH¯]; [H+] > 10-7 моль/л; pH < pOH; pH < 7;
нейтральная среда: [H+] = [OH¯] = 10-7 моль/л; pH = pOH = 7;
щелочная среда: [H+] < [OH¯]; [H+] < 10-7 моль/л; pH > pOH; pH >7;
Таким образом, значения pH всех водных растворов электролитов укладывается в шкалу pH от 0 до 14.
22.Гидролиз солей. Различные типы гидролиза. Ступенчатый гидролиз. Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).
Различают обратимый и необратимый гидролиз солей[1]:
1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):
CO32− + H2O = HCO3− + OH− Na2CO3 + Н2О = NaHCO3 + NaOH (раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
Cu2+ + Н2О = CuOH+ + Н+ CuCl2 + Н2О = CuOHCl + HCl (раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
3. Гидролиз соли слабой кислоты и слабого основания:
2Al3+ + 3S2− + 6Н2О = 2Al(OH)3(осадок) + ЗН2S(газ) Al2S3 + 6H2O = 2Al(OH)3 + 3H2S (равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален. См. также Электролитическая диссоциация.
арсенит цинка Zn(AsO2)2 1 Zn(AsO2)2+H2O →ZnOHAsO2+HAsO2 Zn+H2O →ZnOH+H 2 ZnOHAsO2+H2O →Zn(OH)2AsO2+HAsO2 ZnOH+H2O→Zn(OH)2+H 3 Zn(OH)2AsO2 +H2O→Zn(OH)3AsO2 +HAsO2 Zn(OH)2+H2O→Zn(OH)3+H общее уравнение:Zn(AsO2)2+3H2O →Zn(OH)3AsO2 +3HAsO2 Zn+3H2O→Zn(OH)3+3H
23. Взаимное усиление гидролиза. Гидролиз кислых и основных солей. 24. Количественные характеристики гидролиза: степень и константа гидролиза. Определение рН растворов гидролизующихся солей.
