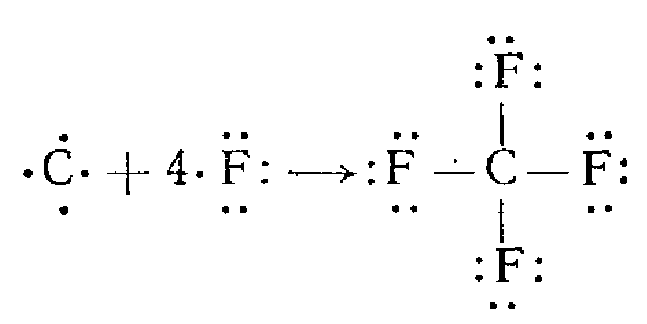- •Вопрос № 1. Основные положения теории валентных связей (мвс).
- •Вопрос № 3. Валентность. Различные трактовки понятия валентность в современной химии. Валентные возможности атомов с позиции мвс. Постоянная и переменная валентность.
- •Вопрос № 5. Концепция гибридизации ао и пространственное строение молекул.
- •Вопрос № 6. Зависимость с-в в-в от хар-ра хим связей в них. Термическая устойчивость в-в, их реакционная способность, склонность к электролитической диссоциации.
- •Вопрос № 7. Межмолекулярное взаимодействие (силы Ван–дер-Ваальса). Водородная связь, ее природа и колич хар – ки. Меж- и внутримолекулярная водородная связь.
- •Вопрос № 8. Химическое равновесие. Его динамический хар-р. Константа хим равновесия. Сдвиг хим равновесия (принцип Ле-Шателье).
- •Вопрос № 9. Соотношение величин константы равновесия и изменения энергии Гиббса. Направление протекания реакции. Термодинамический анализ. Возможности протекания хим р-ций.
- •Вопрос № 13. Сильные и слабые электролиты. Степень диссоциации электролитов. Равновесие в р-рах слабых электролитов. Константа диссоциации. Связь Кд и α.
- •Вопрос № 14. Теория кислот и оснований Бренстеда. Ее основные положения.
- •Вопрос № 15. Основные представления теории сильных электролитов. Истинная и кажущаяся степень диссоциации в р-рах сильных электролитов. Активность. Коэффициент активности.
- •Вопрос № 16. Обменные р-ции м-у ионами в р-ре. Условия протекания обменных реакций.
- •Вопрос № 17. Диссоциация воды. Константа диссоциации воды. Ионное произведение воды. Водородный показатель.
- •Вопрос № 18. Гидролиз солей. Гидролиз солей по катиону и аниону. Механизм гидролиза. Константа гидролиза.
- •Вопрос № 21. Электродный потенциал и его определяющие факторы. Уравнение Нернста.
- •Вопрос № 22. Электрохимический рад напряжения (активности) Ме. Положение Ме в ряду и хим активность Ме.
- •Вопрос № 23. Окислительно-восстановительные потенциалы и направления протекания овр. Соотношение м-у величинами разности окислительно-восстановительных потенциалов и изменением энергии Гиббса.
- •Вопрос № 24. Подбор окислителей и восстановителей с учетом стандартных окислительно-восстановительных потенциалов.
- •Вопрос № 25. Составление уравнений овр. Подбор коэффициентов: ионно-электронный м-д (м-д полуреакций):
Общая химия
Вопрос № 1. Основные положения теории валентных связей (мвс).
Метод валентных связей впервые был использован в 1927 г. немецкими учеными В. Гейтлером и Ф. Лондоном, которые провели квантово-механический расчет молекулы водорода. В методе ВС предполагается, что атомы в молекуле сохраняют свою индивидуальность. Электронная пара заселяет орбиталь то одного, то другого атома. Гейтлер и Лондон показали, что при сближении двух атомов водорода с антипараллельными спинами происходит уменьшение энергии системы (кривая 1), что обусловлено увеличением электронной плотности в пространстве между ядрами взаимодействующих атомов. Рассчитанная ими энергия связи отличалась от экспериментальной не более, чем на 10%. При сближении атомов с параллельными спинами энергия системы возрастает (кривая 2) и молекула в этом случае не образуется.
Позднее метод ВС получил дальнейшее развитие и был распространен на другие молекулы. Метод ВС базируется на следующих основных положениях:
1. Химическая связь между двумя атомами возникает как результат перекрывания АО с образованием электронных пар (обобществление двух электронов);
2. Атомы, вступающие в химическую связь, обмениваются между собой электронами, которые образуют связывающие пары. Энергия обмена электронами между атомами (энергия притяжения атомов) вносит основной вклад в энергию химической связи. Дополнительный вклад в энергию связи дают кулоновские силы взаимодействия частиц;
3. В соответствии с принципом Паули химическая связь образуется лишь при взаимодействии электронов с антипараллельными спинами;
4. Хар-ки химической связи (энергия, длина, полярность и др.) определяются типом перекрывания АО.
Согласно теории ВС, ковалентная связь направлена в сторону максимального перекрывания АО реагирующих атомов.
Следует отметить, что электронная структура молекулы значительно отличается от электронной структуры образующих ее атомов. Например, электронные орбитали в молекуле водорода не имеют сферической симметрии, как АО атомов водорода, так как электронная пара постоянно меняет свое положение относительно двух ядер в молекуле. Электронная пара в молекуле водорода находится на более низком энергетическом уровне, чем уровень электронов в атомах водорода.
Изменения претерпевает электронная структура внешних оболочек и подоболочек атомов, которая в основном и определяет природу и свойства атомов. Поэтому в образовавшейся молекуле атомы с исходной электронной структурой не существуют. У атомов в молекуле сохраняются лишь электронные конфигурации внутренних электронных оболочек, не перекрывающихся при образовании связей. Последнее дает удобную возможность говорить о том, что молекулы состоят из тех или иных атомов, ПР: молекула диоксида серы – из двух атомов кислорода и одного атома серы.

Вопрос № 3. Валентность. Различные трактовки понятия валентность в современной химии. Валентные возможности атомов с позиции мвс. Постоянная и переменная валентность.
Под валентностью подразумевается свойство атома данного элемента присоединять или замещать опре-
деленное число атомов другого элемента. Мерой валентности поэтому может быть число химических связей, образуемых данным атомом с другими атомами. Таким образом, в настоящее время под валентностью химического элемента обычно понимается его способность (в более узком смысле — мера его способности) к образованию химических связей. В представлении метода валентных связей численное значение валентности соответствует числу ковалентных связей, которые образует атом. Образование молекулы водорода из атомов можно представить следующим образом (точка означает электрон, черта — пару элект-ронов): Н∙ + ∙Н =Н:Н или Н∙ + ∙Н = Н – Н
Поскольку пребывание двух электронов в поле действия двух ядер энергетически выгоднее, чем нахождение каждого электрона в поле своего ядра, в образовании ковалентных связей могут принимать участие все одноэлектронные облака. Например, атомы кислорода и азота могут соединяться с двумя и тремя (соответственно) одновалентными атомами водорода:
В ряде случаев число непарных электронов увеличивается в результате возбуждения атома, вызывающего распад двухэлектронных облаков на одноэлектронные. Например, атом углерода в основном состоянии имеет два непарных электрона (2s22p2), а при возбуждении одного из 2s-электронов в 2p-состояние возникают четыре непарных электрона:
Вследствие этого атом углерода может соединяться, например, с четырьмя атомами фтора (2s22p5), имеющими по одному непарному электрону:
Возбуждение атомов до нового валентного состояния требует затраты определенной энергии, которая компенсируется энергией, выделяемой при образовании связей.
Валентные возможности элементов. Имея в виду оба описанные выше механизма образования ковалентной связи, рассмотрим валентные возможности атомов бора, углерода и азота. Это элементы 2-го периода, и, следовательно, их валентные электроны распределяются по четырем орбиталям внешнего слоя: одной 2s- и трем 2р-.
Поскольку у бора и углерода имеются энергетически близкие свободные 2p-орбитали, при возбуждении эти элементы могут приобрести новые электронные конфигурации. В соответствии с числом непарных электронов атомы В, С и Nмогут образовать соответственно три, четыре и три ковалентные связи, например с атомами водорода:
Атом бора имеет свободную орбиталь, поэтому в молекуле ВН3 дефицит электронов. В молекуле же Н3N при атоме азота имеется неподеленная (несвязывающая) электронная пара. Таким образом,молекула ВН3 может выступать как акцептор, а молекула Н3N, наоборот,— как донор электронной пары. Иными словами, центральные атомы той и другой молекулы способны к образованию четвертой ковалентной связи по донорно-акцепторному механизму.
Простейший донор электронной пары—гидрид-ион Н-. Присоединение отрицательного гидрид-иона к молекуле ВН3 приводит к образованию сложного (комплексного) иона ВН4- с отрицательным зарядом:
Простейший акцептор электронной пары — протон Н-; его присоединение к молекуле Н3N тоже приводит к образованию комплексного иона NH4+, но уже с положительным зарядом:
Из сопоставления структурных формул молекулы СН4 и комплексных ионов ВН4- и H3N4+ видно, что атомы бора, углерода и азота в этих соединениях четырехвалентны. Следует отметить, что в ионах ВН4- и H3N4+ все четыре связи равноценны и неразличимы, следовательно, в ионах заряд делокализован (рассредоточен) по всему комплексу.
Рассмотренные примеры показывают, что способность атома образовывать ковалентные связи обусловливается не только одноэлектронными, но и двухэлектронными облаками или соответственно наличием свободных орбиталей.
![]() Многие
элементы в своих соединениях проявляют
постоянную валентность. Но есть элементы,
обладающие
переменной валентностью (таблица).
Водород, натрий и калий во всех
соединениях
одновалентны, кислород, кальций
и магний проявляют постоянную валентность
равную
двум (П). Медь, железо и некоторые другие
элементы могут менять свою валентность.
Их называют элементами с переменной
валентностью. Она зависит от природы
и условий
взаимодействия
элементов в соединении. Например,
при сгорании угля на воздухе образуется
диоксид
углерода (СО2), а при недостаточном
поступлении воздуха - монооксид углерода
(СО). В первом соединении углерод
четырехвалентен, а во втором -
двухвалентен.
Многие
элементы в своих соединениях проявляют
постоянную валентность. Но есть элементы,
обладающие
переменной валентностью (таблица).
Водород, натрий и калий во всех
соединениях
одновалентны, кислород, кальций
и магний проявляют постоянную валентность
равную
двум (П). Медь, железо и некоторые другие
элементы могут менять свою валентность.
Их называют элементами с переменной
валентностью. Она зависит от природы
и условий
взаимодействия
элементов в соединении. Например,
при сгорании угля на воздухе образуется
диоксид
углерода (СО2), а при недостаточном
поступлении воздуха - монооксид углерода
(СО). В первом соединении углерод
четырехвалентен, а во втором -
двухвалентен.
![]()