
- •Изменение по группе атомных радиусов, иозационных потенциалов, сродства к эл – ну и эо.
- •Валентность и степени ок – я
- •Нахождение в природе.
- •Основные типы соединений
- •Изменение по группе устойчивости соед – ий в высшей со атомов
- •Признаки металличности у йода
- •Особенности фтора.
- •История открытия эл-тов.
Химия элементов
Вопрос № 1. Водород. Особенность положения водорода в ПС. Строение атома. Валентность и СО атомов. Хар-р хим связей в соед-ях. Условия образования и сущ-я ионов Н+, Н-, Н3О+. Биологическая роль водорода.
Водород - первый элемент и один из двух представителей первого периода системы. По электронной формуле 1s1 он формально относится к s-элементам и является аналогом типических элементов I группы (лития и натрия) и собственно щелочных металлов. Это обусловливает сходство оптических спектров водорода и щелочных металлов. Водород и металлы 1А-группы проявляют степень окисления +1 и являются типичными восстановителями (валентность = 1). Однако в состоянии однозарядного катиона Н+ (протона) водород не имеет аналогов. В молекулах 1А-группы валентный электрон экранирован электронами внутренних орбиталей. У атома водорода отсутствует эффект экранирования, чем и объясняется уникальность его свойств. Кроме того, единственный электрон атома водорода является кайносимметричным, а потому исключительно прочно связан с ядром (I1 = 13,6 В или 1312 кДж/моль).
С другой стороны, как у водорода, так и у галогенов не хватает одного электрона до электронной структуры последующего благородного газа. Действительно, водород, подобно галогенам, проявляет степень окисления -1 и окислительные свойства. Сходен водород с галогенами и по агрегатному состоянию, и по составу молекул Э2. Но МО водорода не имеют ничего общего с таковыми молекул галогенов. В то же время МО Н2 имеют определенное сходство с МО двухатомных молекул щелочных металлов, существующих в парообразном состоянии.
Таким образом, в отличие от других элементов ПС у водорода нет истинных элементов-аналогов вследствие исключительности строения его атома. Не случайно только для соединений водорода в СО +1 имеет место специфический вид связи — водородная связь.
Все это свидетельствует о том, что в ПС водороду должно быть отведено необычное место. Водород по праву занимает место как в VII группе, так и в I условно.
В простых солеобразованных гидридах существует анион Н- - один из самых сильных восстановителей. Образуется он из молекул водорода:
½ Н2 (г) = Н (г), ΔН = 218,0 кДж/моль,
Н(г) + е-= Н-(г), ΔН = -66,9 кДж/моль
------------------------------------------------
½ Н2 (г) + е-= Н-(г), ΔН = 151,1 кДж/моль
Водород в соед-ях с неМе поляризован положительно. Поскольку сам является неМе, эти соед-я сравнительно малополярны.
Если ионизации подвергнута молекула водорода, то образуется положительно заряженный «молекулярный» ион: Н2 + 357 ккал = Н2+. В ионе Н2+(для которого d(НН) = 1,06А) между обоими ядрами осуществляется одноэлектронная связь. Она значительно менее прочна, чем обычная двухэлектронная связь в нейтральной м-ле Н2.
Свободный водородный ион в р-ре тотчас связывается с м-лой воды, образуя ион оксония – Н3О-, представляющий собой треугольную пирамиду с кислородом в вершине (d(ОН) = 0,98 А, угол НОН = 110). Оксониевые соли в свободном состоянии известны только для некоторых наиболее сильных кислот (ОН3СlО4), т.к. большинство из них обладают малой устойчивостью, а вот [(CH3)3 O]SbCl6.
В соединениях водород образует ковалентные (SiН4, ВН3, НСl), ионные (КН, СаН2) и водородные связи.
Биологическое значение концентрации ионов водорода распространяется на растительные ор-мы: каждый вид наземных растений для своего наиболее успешного развития требует наличия в пожве определенной концентрации водородных ионов. Создает среду в животном организме. рН крови здорового человека 7,35, желудочного сока и пота, мочи рН =6 ,слюны рН = 7, желчи рН = 8.
Вопрос № 2. Нахождение водорода в природе. Изотопный состав. Различные св-ва соед-ий, содерж различ изотопы водорода. Изотопы водорода в природе и технике. История открытия водорода и его изотопов.
Водород - самый распространенный элемент Вселенной. Он составляет основную массу Солнца, звезд и других космических тел. В недрах звезд на определенной стадии их эволюции протекают разнообразные термоядерные реакции с участием водорода. Они и являются источником неисчислимого количества энергии, излучаемого звездами в космическое пространство. Распространенность водорода на Земле существенно иная. В свободном состоянии на Земле он встречается сравнительно редко — содержится в нефтяных и горючих газах, присутствует в виде включений в некоторые минералы. Некоторое количество водорода появляется постоянно в атмосфере в результате разложения органических веществ микроорганизмами, но затем водород быстро перемещается в стратосферу вследствие его легкости. Основная масса водорода в земной коре находится в виде химических соединений с другими элементами: большая часть его связана в форме воды, глин и углеводородов; последние составляют основу нефти и входят составной частью в природные горючие газы. Кроме того, растительные и животные организмы содержат сложные вещества, в состав которых обязательно входит водород. Общее содержание водорода составляет 0,88% массы земной коры, и по распространенности на Земле он занимает 9-е место.
Природный водород представляет собой смесь изотопов: протия 11Н, дейтерия 21Н (или 21D) и трития 31Н (или 31Т). Искусственно получены еще два изотопа водорода: 41Н и 51Н, но они весьма неустойчивы. Ядра протия и дейтерия стабильны. Тритий же радиоактивен: выбрасывая электрон, он превращается в легкий изотоп гелия 32Не с периодом полураспада 12,26 года. В естественной смеси изотопов преобладает протий (99,985%), массовое содержание дейтерия меньше (порядка 0,015%), содержание трития ничтожно. Количественные соотношения между изотопами водорода Н:D:Т могут быть представлены как 1:1,45*10-5:4,0*10-15.
Для водорода как ни для какого другого элемента, относительное различие изотопных масс достигает значительной величины. Поэтому, хотя все изотопы хар-ся одинаковой электронной структурой, они заметно различаются не только физическими, но и химическими свойствами. Вследствие резкого преобладания протия влияние тяжелых изотопов сказывается незначительно и может быть зафиксировано лишь в очень точных экспериментах. Поэтому без большой погрешности можно считать, что свойства природного водорода соответствуют свойствам системы состоящей из чистого протия.
Небольшие различия свойств, именуемые изотопным эффектом, обусловлены различием масс изотопных атомов, которое в первую очередь сказывается на частоте колебаний изотопов в молекулах и твердых телах. Так, колебательная Е молекул трития и дейтерия меньше, чем протия. А это, в свою очередь, сказывается на термодинамических свойствах: теплоемкости, температуре плавления и кипения, энтальпии плавления и испарения, давлении насыщенного пара и т.д. Так, D по сравнению с обычным водородом обладает меньшей теплоемкостью, теплопроводностью и скоростью диффузии.
Т.о., для изотопных соединений характерна термодинамическая неравноценность. Последняя ведет к неравноценности активных комплексов при химических реакциях, в результате чего имеет место различие в скоростях протекания реакций, т.е. наблюдается кинетический изотопный эффект. Он выражается отношением констант скоростей химических реакций для различных изотопных соединений. ПР: отношение констант скоростей синтеза бромидов протия и дейтерия = 5. Такие значительные отличия физических и химических свойств изотопов одного и того же элемента уникальны и не имеют аналогов в ПС. Все это в какой-то мере оправдывает применение для каждого изотопа водорода собственного названия (особенно для протия и дейтерия).
Изотопы водорода – D, Т – нашли важное применение в атомной энергетике (термоядерное горючее).
Вопрос № 4. Способы получения молекулярного водорода в лаборатории и пром-ти. Применение водорода. Принцип работы высокотемпературных водород-кислородных горелок. Водород как перспективное горючее.
Конверсионный метод получения водорода основан на каталитических реакциях взаимодействия водяного пара с метаном (главный компонент природного газа), а затем с монооксидом углерода (продукт реакции):
СН4 + Н2О → СО + 3Н2, ΔН◦298 = 206,2 кДж 2Fe + 3Н2О → Fe2О3 + 3Н2
СО + Н2О → СО2 + Н2, ΔН◦298 = -41,2 кДж С + Н2О → СО + Н2
Эндотермичность процесса конверсии метана можно частично восполнить энергией, выделяющейся при неполном его окислении. Для проведения такого процесса природный газ смешивается с водяным паром и кислородом, а реакция протекает по схеме:
3СН4 + Н2О + О2 → 3СО + 7Н2
Важным способом получения водорода является выделение его из коксового газа и газов нефтепереработки путем глубокого охлаждения. При этом в газообразном состоянии остается только водород, а все остальные компоненты исходной газовой смеси конденсируются. Электролиз воды обеспечивает получение наиболее чистого водорода:
Н2О ↔ Н+ + ОН-
НCl → Н+ + Cl-
К: Н+ + 1е → Н Н + Н = Н2
А: ОН- - 2 е → Н2О + О О + О → О2
Cl- + 1е → Сl Сl + Сl → Cl2
В лаб. условиях водород обычно получают действием цинка на соляную или серную кислоту (проводится в аппарате Киппа): Zn + HCl → ZnСl2 + H2, СаН2 +2Н2О = 2Н2 + Са(ОН)2
Основная часть водорода используется для синтеза аммиака N2 + 3H2 = 2NH3 и получения метанола
СО + 2Н2 → СН3ОН кат ZnO. Кроме того, водород используется для гидрирования в нефтепереработке, при получении маргарина, для получения металлов (W, Mo), в криогенной технике, на электростанциях для охлаждения генераторов эл тока.
Жидкий водород используют как одно из наиболее эффективных реактивных топлив. В настоящее время проблема использования водорода приобрела особое значение. Энергетический кризис, проблема защиты окружающей среды от непрерывного и угрожающего загрязнения нефтью и продуктами сгорания органических топлив — все это стимулирует резкое возрастание интереса к водороду как «экологически чистому» горючему. Водород — основа химической технологии и энергетики будущего.
Вопрос № 5. Гидриды. Типы гидридов: ковалентные, ионные, полимерные, нестехиометрические. Водородные соединения s- и р-элементов, их типы по отношению к воде.
В тех случаях, когда водород выступает в качестве окислителя, он ведет себя как галоген, образуя аналогичные галогенидам гидриды. Однако в отличие от образования галогенид-ионов образование ионов Н- из молекул Н2 — процесс эндотермический. Энтальпия образования Н- составляет
½ Н2 (г) = Н (г), Н298 =217,5 кДж
Н(г) +е =Н-(г), = Н298 = -72,8 кДж
½ Н2(г) + е =Н(г), Н298 = 144,7 кДж
Поэтому окислительная активность водорода существенно уступает галогенам. По этой же причине ясно выраженный ионный характер проявляют лишь гидриды наиболее активных металлов — щелочных и щелочно-земельных, например КН и СаН2.
Ионные гидриды представляют собой белые кристаллические вещества с высокими температурами плавления, т. е. соли. Их расплавы характеризуются высокой электрической проводимостью, при электролизе расплавленных гидридов водород выделяется на аноде. Гидриды s-элементов I группы, как и большинство галогенидов этих элементов, имеют структуру типа NаС1. В химическом отношении ионные гидриды ведут себя как основные соединения.
К ковалентным относятся гидриды менее электроотрицательных,.чем сам водород, неметаллических элементов. К ковалентным относятся, например, гидриды состава SiН4 и ВН3. По химической природе гидриды неметаллов являются кислотными соединениями.
Нестехиометрические гидриды – гидриды Ме, которые не отвечают нишим представлениям о валентности: SbН3.
Полимерными называются гидриды элементов, полученных различными косвенными путями и представляющие собой малоустойчивые при обычных условиях амфотерные тв в-ва (это гидриды Au, Ag, Hg, Cd, Zn, Tl, In, Ga, Be, Mg, B, Al.
Различие в химической природе гидридов можно легко установить по их поведению при гидролизе. Характерной особенностью гидролиза гидридов является выделение водорода. Реакция протекает по
окислительно-восстановительному механизму. Отрицательно поляризованный атом Н-1 в гидриде и положительно поляризованный атом Н+1 в воде переходят в состояние с нулевой степенью окисления:
КН-1 + Н+1ОН ==КОН + Н20; SiН4-1 +ЗН+1ОН=Н2SiО3 + 4Н2
За счет выделения водорода гидролиз протекает полностью и необратимо (ДЖО, Л5>-0).
Т.О. гидриды s-эл-тов наз основными, а р-эл-тов – кислотными. При этом основные гидриды образуют щелочь, а кислотные — кислоту.
Различие между основными и кислотными гидридами отчетливопроявляется также при их взаимодействии между собой, например, Н Н
LiН + ВН3 = Li[BH4] тетрагидридоборат лития Н:-+ В:Н →[ Н:В:Н]-
Н Н
Эта реакция может протекать лишь в неводных средах, например в эфире.
Гидрид лития, передавая в комплекс ион Н-, выступает как донор электронной пары, а ВН3, присоединяющий гидрид-ион, является акцептором.
В качестве амфотерного соединения можно рассматривать гидрид алюминия А1Н3, который в зависимости от партнера по реакции может выступать и как донор электронных пар (основное соединение), и как акцептор (кислотное соединение):
А1Н3 + ЗВН3 = А1(ВН4)3 гетрагидридоборат алюминия (смешанный гидрид)
КН + А1Н3 = К[А1Н4]гетрагидридоалюминат калия
Ион Н- — один из самых сильных восстановителей. Поэтому ионные, а также комплексные гидриды — сильные восстановители. Они широко применяются для проведения различных синтезов, для получения водорода и в химическом анализе. Гидрид кальция СаН2 используют, кроме того, в качестве осушителя, для удаления следов влаги.
Вопрос № 6. Кислород. Положение в ПС. Строение атома. Валентность и С.О. Хар–р химических связей в соед–ях. Основные типы хим. соед. Нахождение в природе, изотопный состав. История открытия кислорода и его изотопов. Роль кислорода как самого распространенного эл-та в биологических и минеральных процессах на Земле.
Кислород находится в 6 группе глав п/гр 2-го периода.
Строение атома. Электронная конфигурация 1s22s22p4. Атом состоит из 8 электронов и восьми протонов.
Валентность и С.О. В соединениях кислород обычно проявляет С.О -2 и +2. Валентность кислорода равна 2.
Основные типы хим. соед Молекула кислорода состоит из 2-х атомв – хим связь - ковалентная неполярная.
В соединениях с неМе – оксиды неМе связь преимущественно ковалентная, поэтому большинство из них – газы, легко летучие жидкости или легкоплавкие тв в-ва. Оксид хрома и марганца.
В соединениях с Ме – оксиды Ме связь преимущественно ионная. Оксид натрия и кальция.
Несолеобразующие: оксиды осмия углерода и азота 2, оксид рубидия.
Супероксиды или пероксиды.
Амфотерные оксиды бериллий, алюминий, цинк.
Нахождение в природе. Известно более 1400 минералов, содержащих кислород: кварц и его модификации, полевые шпаты, слюды, известняки. Огромное кол-во кислорода находится в воде 90%. В свободном состоянии кислород находится в атмосфере 20,95% по объему и 23,15% по массе. Самый распространенный элемент на земле 47,2% от массы земной коры (литосфера 40%). Содержится в белках, жирах и углеводах, из к-ых состоят живые организмы 65%.
Природный кислород содержит три изотопа: 16/18 (99,76%), 17/8 (0,04%) и 18/8 (0,02%).
История открытия кислорода и его изотопов. Молекулярный кислород впервые был получен швед уч К.Шееле примерно в 1770 при прокаливании селитры: 2KNO3 = 2KNO2 + O2. В 1774 анг химик Дж. Пристли получил кислород при нагревании оксида ртути.
На протяжении почти полутора веков 1/16 часть массы атома кислорода служила единицей сравнения масс различных атомов между собой и использовалась при численной характеристике масс атомов различных элементов (так называемая кислородная шкала атомных масс).
Роль кислорода. Кислород воздуха расходуется в процессах горения, гниения, ржавения, дыхания и непрерывно регенерируется в процессе фотосинтеза.
Вопрос № 8. Озон как аллотропная модификация кислорода. Строение м-лы. Физ и хим св-ва. Взаимодействие озона с Ме и неМе. Получение и применение озона. Озониды.
В хим строении м-ла озона центральный атом кислорода подвергается sp2-гибридизации, а его орбиталь 2рz с такими ж орбиталями крайних атомов образует р-р-связь вдоль всей молекулы.
Озон – газ синего цвета, м-лы которого диамагнитны. Цвет его обусловлен большой поляризуемостью м-лы озона по сравнению с кислородом.
Озон получают при действии тихого эл-го разряда на кислород. В атмосфере озон образуется при газовых разрядах и в верхних слоях под действием УФ-узлучения. Озон сильно эндотермичен, а поэтому реакционноспособен. Его окислительные св-ва выражены сильнее, чем у кислорода.
Н=-188 кДж/моль О3 + е → О3-, поэтому р-ции типа К + О3 = КО3 протекают самопроизвольно с образованием озонидов Ме. Парамагнетизм и цвет озонидов обусловлены свободным электроном озонид иона.
КО3 = КО2 + О
 Озониды сильные
окислители и хорошо гидролизуются: 2КО3
+ 2Н2О
= 2КОН + Н2О2
+ 2О2
Озониды сильные
окислители и хорошо гидролизуются: 2КО3
+ 2Н2О
= 2КОН + Н2О2
+ 2О2
SO2 + О3 = SО3 + О2
Au + О3 = Au2О3
PbS + 4О3 = PbSО4 + O2
Используют для обеззараживания воды и воздуха.
Вопрос № 9. Особенности строения и св-ва оксидов. Классификация оксидов по типу свяхи элемент – кислород. Классификация оксидов по кислотно-основным св-вам.
Свойства оксидов
Если посмотреть внимательно реакции, написанные выше, то те из них, в которых оксиды встречались в левой части уравнения, будут говорить нам о свойствах оксидов. Эти общие для всех оксидов свойства относятся к окислительно-восстановительным процессам:
2SO2 + O2 = 2SO3, 2SO3 = 2SO2 + O2, Fe2O3 + CO = 2FeO + CO2, Al + Fe2O3 = Al2O3 + Fe,
C + Fe2O3 = CO + 2FeO.
Свойства основных оксидов
CaO + H2O = Ca(OH)2, Ca(OH)2 = Ca2+ + 2OH-,
CaO + SO3 = CaSO4, BaO + Al2O3 = Ba(AlO2)2.
CaO + H2SO4 = CaSO4 + H2O, K2O + Zn(OH)2 = K2ZnO2 + H2O.
CaO + Ca(HCO3)2 = 2CaCO3 + H2O.
MgO + MgCl2 + H2O = 2Mg(OH)Cl.
Свойства кислотных оксидов
SO3 + H2O = H2SO4, H2SO4 = 2H+ + SO42- .
Но есть и такие кислотные оксиды, которые не растворяются в воде и с ней не взаимодействуют: SiO2.
SiO2 + CaO = CaSiO3, 3SO3 + Al2O3 = Al2(SO4)3.
SO3 + Ca(OH)2 = CaSO4 + H2O, SO3 + Zn(OH)2 = ZnSO4 + H2O.
CO2 + CaCO3 + H2O = Ca(HCO3)2.
Свойства амфотерных оксидов
Zn(OH)2 = Zn2+ + 2OH-, H2ZnO2 = 2H+ + ZnO22-.
Амфотерные оксиды не растворяются в вводе.
Al2O3 + K2O = 2KAlO2, Al2O3 + 3SO3 = Al2(SO4)3.
ZnO + 2KOH = K2ZnO2 + H2O, ZnO + H2SO4 = ZnSO4 + H2O.
Несолеобразующие: СО, NO, OsO4, RuO4.
Вопрос № 10. Пероксиды, надпероксиды, озониды, пероксокислоты. Пероксомоносерная и пероксодисерная кислоты, их свойства.
Сродство к электрону молекулы О2 составляет 0,44 эВ, а ее энергия ионизации 12,08 эВ. При химических превращениях молекула О2 может присоединять или терять электроны с образованием молекулярных ионов типа О22- ,О2- и О2+. Удаление электрона с *-орбитали (ММО) молекулы О2 соответствует повышению порядка связи (в О2+), а появление электронов на *-орбитали приводит, наоборот, к уменьшению порядка связи в молекулярных ионах О22- ,О2-. В соответствии с этим в ряду О2+—О2 — О2- —О22- расстояние между атомами кислорода увеличивается, а средняя энергия связи уменьшается.
Присоединение одного электрона к молекуле кислорода вызывает образование надпероксид-ион О2-:
:О—О: + е =[:О—О:]
Производные радикала О2- называются надпероксидами они известны для наиболее активных щелочных металлов (К, RЬ, Сs).Надпероксиды образуются при прямом взаимодействии простых веществ: К+О2=КО2.
Непарный электрон иона О2- обусловливает парамагнетизм надпероксидов и наличие у них окраски. Надпероксиды—очень сильные окислители. Они бурно реагируют с водой с выделением кислорода.
Присоединяя два электрона, молекула кислорода превращается в пероксид-ион О22-, в котором атомы связаны одной двухэлектронной связью, и поэтому он диамагнитен: :О—О: + 2е =[:О—О:]2-. Производные О22- называются пероксидами. Пероксиды образуются при окислении ряда металлов, например: Ва+О2 =ВаО2.
Наибольшее практическое значение имеет пероксид (перекись) водорода Н2О2. Энергия связи О—О (210 кДж/моль) значительно меньше энергии связи О—Н (468 кДж/моль).
Вследствие несимметричного распределения связей Н—О молекула Н2О2 сильно полярна (μ =0,7 •10-29 Кл*м). Между молекулами Н2О2 возникает довольно прочная водородная связь, приводящая к их ассоциации. Поэтому в обычных условиях пероксид водорода—сиропообразная жидкость (пл. 1,44) с довольно вы-
сокой температурой кипения (т. кип. 150,2 °С, т. пл. 0,41 °С). Она имеет бледно-голубую окраску. Пероксид водорода — хороший ионизирующий растворитель. С водой смешивается в любых
отношениях благодаря возникновению новых водородных связей. Из растворов выделяется в виде неустойчивого кристаллогидрата Н2О2 *2Н2О (т. пл. —52,0 °С). В лаборатории обычно используются 3%-ные и 30%-ные -растворы Н2О2 (последний называют пергидролем).
В водных растворах пероксид водорода — слабая кислота: Н2О ... Н2О2 ОН3+ + НО2- - гидропероксид-ион. В химических реакциях пероксид-радикал может, не изменяясь, переходить в другие соединения, например: В2О2 + Н2SО4 = ВаSО4 + Н2О2
Чаще, однако, протекают реакции, сопровождающиеся разрушением связи О—О или изменением заряда иона О22-. Эти процессы можно трактовать как проявление ионом О22- окислительных и восстановительных свойств: О22- +2е = 2О-2 окислитель О22- -2е = 2О0 восстановитель
Окислительные свойства пероксидов выражены сильнее, чем восстановительные:
Н2О2+2Н+ + 2е-=2 Н2О, Е298 =1,78В О2+2Н++ 2е-= Н2О2, -Е298= 0.66 В.
Для пероксида водорода характерен также распад по типу диспропорционирования:
Н2О2-1 + Н2О2-1 = 2Н2О-2 + О20
Этот распад ускоряется в присутствии примесей, при освещении, нагревании и, может протекать со взрывом. Довольно устойчивы только очень чистая Н2О2 и ее 30—65%~ные растворы.
Кислоты, в которых имеется группировка О22- , называют пероксокислотами.
При их гидролизе образуется пероксид водорода, что используется для его получения в промышленности. Характерным свойством пероксидных соединений, как простых, так и комплексных, является способность образовывать пероксид водорода при взаимодействии с разбавленными растворами кислот, а также выделять кислород при термическом разложении или действии воды и других химических агентов. Другие
неорганические соединения, которые могут быть источником кислорода, как, например, нитраты, хлораты, перхлораты, перманганаты и некоторые оксиды, при действии воды не выделяют пероксид водорода. Кислород они выделяют только при нагревании и в присутствии катализаторов.
Сродство к электрону озона около 180 кДж/моль, поэтому он может переходить в озонид-ион О3-. В частности, при действии озона на щелочные металлы образуются озониды: К+О3=КО3
Озониды — это соединения, состоящие из положительно заряженных ионов металла и отрицательно заряженных ионов О3-
-
 .Наличие
в ионе О3-
непарного электрона
обусловливает парамагнетизм и наличие
окраски у озонидов. Обычно они окрашены
в красный цвет.
.Наличие
в ионе О3-
непарного электрона
обусловливает парамагнетизм и наличие
окраски у озонидов. Обычно они окрашены
в красный цвет.
Вопрос № 11. Вода. Строение м-лы воды по МВС и ММО. Химические св-ва.
Молекула воды имеет угловую форму, что согласно теории валентных связей соответствует sр3-
гибридному состоянию атома кислорода. В. молекуле Н2О две sp3-гибридные орбитали атома кислорода участвуют в образовании двух связей О—Н. На двух других sp3-гибридных орбиталях расположены две несвязывающие электронные пары. Валентный угол воды составляет 104,5°.
В рамках теории молекулярных орбиталей рассмотренная модель молекулы воды соответствует распределению восьми валентных электронов по двум связывающим и двум несвязывающим молекулярным орбиталям (sсв)2(zсв)2(х)2(у)2(z*)2(s*) и наличию двух свободных разрыхляющих орбиталей.
Вода частично диссоциирует на ионы водорода и гидроксида. Вода – амфотерное соединение, т.е. может быть как кислотой: N2H4 + H2O N2H5+ + OH- так и основание H2O + HCl H3O- + Cl-.
Вода может быть как окислителем, так и восстановителем. Сильные окислители окисляют ее с выделением кислорода: Н2О + F2 2НF + ½ О2. С хлором образуются 2 кислоты: Н2О + Cl2 НCl + HClО.
Сильные вос-ли восстанавливают ее с выделение водорода: 2Н2О + Са Н2 + Са(ОН)2.
При повышенной температуре водяной пар взаимодействует с СО (кат) и метаном (кат):
Н2О + СО Н2 + СО2, 2Н2О + СН4 4Н2 + СО2.
Вода является лигандом и координируется как катионами [M(H2O)m]n+, так и анионами [А(H2O)m]n-. Вода взаимодействует с анионами слабых кислот и катионами слабых оснований.
Вода является катализатором многих реакций. ПР: щел Ме взаимодействуют при комнатной температуре только в присутствии следов воды. Т.к. м-лы воды полярны, то они хорошо растворяют многие полярные и диссоциирующие на ионы соединения. В воде также хорошо растворимы в-ва, образующие с водой водородные связи (SO2, NH3, C2H5OH). Растворимость в воде малополярных в-в низкая.

Вопрос № 12. Физические св-ва воды. Диаграмма состояния воды. Строение и свойства твердой, жидкой и газообразной воды. Ассоциация. Химически связанная вода. Клатраты. Радиолиз воды.
Физические свойства воды. Температура плавления воды 0°С, кипения 100°С, плотность при 20°С — 0,998 г/см3, температурный коэффициент объемного расширения (К-1) воды при 20°С - +2*10-4, льда при 0°С — -1,2*10-4. Свойства воды существенно отличаются от свойств водородных соединений элементов VI группы. Вода при обычных условиях находится в жидком состоянии, в то время как указанные соединения — газы. Температуры кристаллизации и испарения воды значительно выше температур кристаллизации и испарения водородных соединений элементов VI группы. Максимальную плотность вода имеет при 4°С, что также необычно. В отличие от других соединений плотность воды при кристаллизации не растет, а уменьшается. Вода имеет очень высокую диэлектрическую проницаемость. Так, при 298 К диэлектрическая проницаемость ее равна 78,5, в то время как для Н2S она меньше 10.
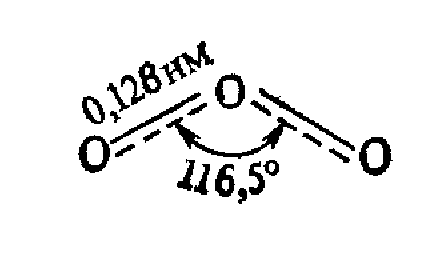
Строение воды. Долгое время необычные свойства воды были загадкой для ученых. Выяснилось, что они в основном обусловлены тремя причинами: полярным характером м-л, наличием неподеленных пар электронов у атомов кислорода и образованием водородных связей. Молекула водорода может быть представлена в виде равнобедренного треугольника, в вершине к-го располоден атом кислорода, а в основании - два протона. 2 пары электронов обобществлены между протонами и атомами кислорода, а две пары неподеленных электронов ориентированы по другую сторону кислорода. Длина связи О – Н составляет 96 нм, а угол между связями 105°. Связь О-Н имеет полярный хар-р, м-ла воды также полярна. Вследствие полярности вода хорошо растворяет полярные жидкости и соединения с ионными связями.
Наличие неподеленных пар электронов у кислорода и смещение обобществленных электронных пар от атомов водорода к атомам кислорода обусловливают образование водородных связей м-у кислородом и водородом.
Хотя водородные связи слабее ковалентных и ионных они значительно прочнее вандерваальсовых связей и обусловливают ассоциацию молекул воды в жидком состоянии и некоторые аномальные свойства воды, в частности высокие температуры плавления и парообразования, высокую диэлектрическую проницаемость, максимальную плотность при 4°С, а также особую структуру льда. В кристаллах льда молекула воды образует четыре водородные связи с соседними молекулами воды (за счет двух
неподеленных электронных пар у кислорода и двух протонов), что обусловливает возникновение тетраэдрической кристаллической структуры льда.
Расположение молекул в таком кристалле отличается от плотной упаковки молекул, в решетке много свободных мест, поэтому лед имеет относительно невысокую плотность. При высоких давлениях - (выше 200 МПа) обеспечивается более плотная укладка молекул воды и возникает еще несколько кристаллических модификаций льда. При плавлении происходит частичное разрушение структуры льда и сближение молекул, поэтому плотность воды возрастает. В то же время повышение температуры усиливает движение молекул, которое снижает плотность вещества. При температуре выше 4°С последний эффект начинает превалировать и плотность воды понижается.
В жидкой воде молекулы ассоциированы, т.е. объединены в более крупные частицы, причем устанавливается равновесие между молекулами воды, связанными в ассоциаты, и свободными молекулами воды. Наличие ассоциатов повышает температуру кристаллизации испарения воды и диэлектрическую проницаемость. При увеличении температуры растет доля свободных молекул. При испарении ассоциаты разрушаются и водяной пар при невысоких давления состоит из свободных молекул Н2О. Однако при повышении давления молекулы воды сближаются и образуют водородные связи, происходит ассоциация молекул. По мере повышения давления пар приближается по своему строению к жидкому состоянию. Это вызывает увеличение растворимости в паре соединений с ионными связи.
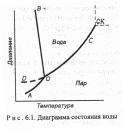
Диаграмма состояния воды. Области, находящиеся м-у кривыми, являются однофазными областями (С = 2). Кривые соответствуют условиям равновесия между двумя фазами (С = 1). Кривая ОС отражает равновесие процесса кипения. Кривая кипения оканчивается точкой С, которая называется критической. При температуре выше этой точки невозможно получить жидкую воду ни при каком давлении. Вода при температурах выше критической и давлении, выше критического, переходит в особое состояние, называемое сверхкритическим. Свойства веществ в этом состоянии находятся между свойствами газа и жидкости. Например, вещества в сверхкритическом состояние имеют очень низкую вязкость, высокие диффузионную активность и способность растворять многие вещества в твердом, жидком или газообразном видах. Критическая температура для воды, например, 647 К. Критическое давление для воды 21,8 МПа.
Кривая 0В — это кривая плавления. При увеличении давления температура плавления несколько уменьшается, что обусловлено разрывом водородных связей при повышении давления. Для
большинства веществ температура плавления немного возрастает с увеличением давления.
Кривая ОА отражает процесс сублимации, т. е. перехода из твердого состояния в газообразное, минуя жидкое. Кривая 0В описывает поведение воды в неустойчивом (метастабильном) состоянии. Явление образования метастабильного состояния получило название переохлаждения.
В точке О существует равновесие одновременно между тремя фазами. Такие точки называются тройными. Для воды в тройной точке давление равно 610 Па и температура 2 73,15 К.
Строение и свойства твердой, жидкой и газообразной воды. Жидкая вода в тонких слоях бесцветна, а в толстых имеет голубовато-зеленый цвет. Противоположность почти всем другим в-ва, плотность к-ых по мере охлаждения все время возрастает, вода имеет наибольшую плотность при +4С.
Чистая вода почти не проводит эл ток. Она хар-ся наибольшей из всех жид и тв в-в удельной теплоемкостью, т.е. для нагревания воды требуется затратить больше тепла, чем для нагревания на тоже число градусов равного по массе кол-ва к-л др жидкости и тв тела.
При низких температурах вода испаряется сравнительно медленно, но при нагревании давление ее пара быстро возрастает. Обычно воздух содержит от 30 до 90% максимально возможного кол-ва водяного пар, тогда пар будет насыщенный. При охлаждении ненасыщенного водяным паром воздуха постепенно достигается состояние насыщения, после чего избыточный водяной пар начинает выделятся в виде тумана или – при резком охлаждении – в виде дождя. Если весь процесс проходит при более низких температурах, получается соответственно иней или снег.
При охлаждении воды до 0 градусов она переходит в тв состояние – лед. Плотность льда = 0,92 г/см3., т.е. он легче воды. Радиолиз воды. Вода под влиянием радиоактивного излучения разлагается по схеме с последующим частичным образованием Н2, Н2О2, О2. По-видимому, первичной при радиолизе воды является реакция Н2О → е + Н2О+, после чего протекают процессы Н2О+ → Н+ + ОН и Н2О + е → Н + ОН-.
Клатраты. Соединения включения (клатраты) - системы, образовавшиеся в результате обратимого внедрения молекул одного вещества («гостя») в свободные полости кристалла другого вещества («хозяина»), В соединениях включения межмолекулярное взаимодействие молекул «гостя» с составными частями кристалла играет второстепенную роль. К клатратам, например, относятся так
называемые гидраты газов, которые образуются за счет включения в междоузельные пространства кристалла льда молекул С12, СН4, Н2S, Аr, Хе, SО2 или др. В одной из модификаций льда на 46 молекул воды приходится 8 свободных полостей; отсюда средний состав аких кристаллогидратов клатратного типа Х*5,75Н2О или округленно Х*бН2О (X — молекула «гостя»). Встречаются также гидраты газов состава Х7,7*Н2О (Х*8Н2О).
Газовые гидраты — твердые кристаллические вещества, напоминающие по внешнему виду снег или рыхлый лед. Первым был получен гидрат хлора Сl*бН2О (Дэви, 1811) при охлаждении насыщенного хлором водного раствора до 9 °С. Клатраты применяются для опреснения морской воды.
К латраты
в природе часто выполняют роль
естественного хранилища газов.
Так,
советскими учеными (А. А. Трофимук и др.)
в районах вечной мерзлоты обнаружены
на значительной глубине в недрах земли
твердые газовые гидраты метана — важный
источник ценного сырья.
латраты
в природе часто выполняют роль
естественного хранилища газов.
Так,
советскими учеными (А. А. Трофимук и др.)
в районах вечной мерзлоты обнаружены
на значительной глубине в недрах земли
твердые газовые гидраты метана — важный
источник ценного сырья.
Вопрос № 14. Сложные соединения кислорода в положительных и нулевых степенях окисления. Фториды кислорода. Производные катиона диоксигенила. Комплексные соединения молекулярного кислорода.
Положительная степень окисления кислорода проявляеся в его соединениях с фтором, а также в ионе О2+ - диоксигенил.
Простейший представитель такого рода соединений – дифторид кислорода ОF2; его получают при быстром пропускании фтора ч-з 2%-ый раствор щелочи: 2F2 + 2NaOH = OF2 + 2NaF + H2O.
Дифторид кислорода – ядовитый газ бледно-желтого цвета, термически устойчив (до 200-250С), сильный окислитель, эффективный фторирующий агент.
В диоксидифториде О2F2 радикал О2+ ковалентно связан с атомами фтора. Это соединение образуется (в виде красной летучей жидкости) в результате непосредственного взаимодействия простых веществ в электрическом разряде или под действием ионизирующих излучений при температуре жидкого воздуха (—190 °С). Согласно спектроскопическим данным молекула О2F2 (μ=0,48 •10-29 Кл-м) по структуре аналогична Н2О2:

Соединение крайне неустойчиво, что определяется низкой энергией разрыва связи ОF (75 кДж/моль).
Получены также полиоксидифториды типа О4F2, О5F2, О8F2, существующие лишь при низкой температуре (—190 °С). Предполагают, что их молекулы имеют цепное строение, например:
![]()
Термическая устойчивость оксидифторидов уменьшается с увеличением числа атомов в молекуле ОnF2 (n = 2—6).
Энергия ионизации молекулы О2 довольно значительная (12,08 эВ), однако при взаимодействии О2 с сильнейшим окислителем РtF6 образуется солеподобное вещество О2+[ РtF6]-: О2 + РtF6 = О2+[ РtF6]-, в котором роль катиона играет молекулярный ион О2+ [:О = О:]
Гексафтороплатинат (V) диоксигенила О2[ РtF6] — парамагнитное вещество красного цвета, плавится с разложением при 219 °С. Синтез этого соединения канадским ученым Н. Бартлетом в 1962 г. послужил толчком к синтезу соединений ксенона, энергия ионизации которого близка к таковой молекулы кислорода.
Производные О2+ получены также при взаимодействии О2F2 и О4F2 с резко кислотными фторидами типа ВF3, PF5, AsF5, SbF5, BrF5: О2F2+PF5 = O2[PF6] + ½ F2 О4F2 + 2BF3 = 2O2[BF4]
Синтез диоксигенильных солей межно осуществлять длительным нагреванием (при 150—500 °С) смеси кислорода, фтора и порошка соответствующего металла: О2 + 3F2 + М = О2[ МF6] где М — As, Sb, Bi, Nb, Pt,Au, Ru, Rh.
Частота валентных колебаний О2+ в диоксигенильных соединениях близка к таковой для свободного иона, что подтверждает существование иона О2+ в указанных солях. Межъядерное расстояние в катионе О2+, известное из спектроскопических данных (0,112 нм), как и следовало ожидать, меньше, чем в О2 (0,1207 нм). Ион О2+ имеет один непарный электрон. Энергия диссоциации О2F2, ОF2 (70 кДж/моль) меньше, чем у F2 (159 кДж/моль). Эти фториды — удобная форма хранения фтора, который выделяется при их распаде уже при обычных температурах.
В соединениях типа ClO4F, NO3F один из атомов кислорода играет роль мостикового атома, соединяющего атом хлора или азота с атомом фтора. Такой атом кислорода можно рассматривать, как находящийся в состоянии нулевой степени окисления. Рассматриваемые соединения можно получить при взаимодействии с фтором концентрированных растворов НClO4 и НNO3
или твердых солей КСlO4 и КNO3: HNO3 + F2 = NO3F + HF KClO4 + F2 = ClO4F + KF
В воде эти соединения разлагаются, выделяя кислород: 2ClO4F + Н2О = 2 НClO4 + 2НF + О2/
Производные с положительной степенью окисления кислорода являются сильнейшими окислителями. Их можно использовать как эффективные окислители ракетного топлива.
Вопрос № 15. Галогены. Положение в ПС. Строение атомов. Изотопный состав, формы нахождения в природе. Изменение по группе атомных радиусов, ионизационных потенциалов, сродства к электрону и ЭО. Валентность и С.О атомов.
Галогены находятся в 7 гр главной п/гр.
Изменение по группе атомных радиусов, иозационных потенциалов, сродства к эл – ну и эо.
В ряду F – CI – Вr - J – At
1) радиус атома увеличивается
2) энергия ионизации уменьшается
3) сродство к электрону уменьшается, а у At отсутствует
4) ЭО уменьшается Галогены сильные окислители
5) Ме св - ва усиливаются
6) Ослабление не Ме признаков
Валентность и степени ок – я
В основном состоянии имеют валентность = 1, а в возбужденном (кроме F) -3,5,7.
Галогены легко присоединяют по одному недостающему эл - ну и проявляют ст. ок -я -1.
Однако атомы Hal, кроме F, м. проявлять положит СО: +3; +5; +7. СI и Br ещё и +2, +4.
Максимальная СО, равная N гр., проявл. в соед – и с кислородом: R2 O7
Нахождение в природе.
а) Фтор – довольно распространенный эл – т, и его содержание на Земле составляет ~ 0,03% (мол. доли)
Минералы: Ca F2 –плавиковый шпат (флюорит)
Na3AIP3 – криолит.
Ca5(PO4)3F – фторапатит.
В ор – ме чел: в основном зубах и костях
Изотопы: 19F (природ), с мас числами 16-21 (искусств)
б) CI – встреч. в виде хлоридов
Минералы: NaCI – каменная соль
NaCI KCI –сильвинит
KCI MgCI2. 6H2O – карналлит
Содержится в морской воде, входит во все жив. орг - мы
Изотопы: 35CI и 37CI + радиактив. изотопы.
в) Br и J – распространены в морской воде и нефтяных буровых водах
Изотопы: 79Br и 82Br; 127J + искусств.
г) At –практически не встречается. Ничтожные кол-ва астата обнаружены в продуктах естеств. радиактив распада урана и тория.
Вопрос № 16. Основные типы соединений галогенов. Изменение по группе устойчивости соединений в высшей С.О атомов. Хаар-р хим связей в соед-ях Признаки металличности йода. Особенности фтора История открытия.
Основные типы соединений
С водородом Hal образуют устойчивые соед-я галогеноводороды, водные р – ры к - ых - к – ты.
М – лы всех Hal состоят из 2 – х атомов: F2, Br2, CI2, J2 – хим связь ковал неполяр.
Hal образуют кислородосодержащие к – ты
+1: HCIO, HBrO, HJO3 - галогенноватистая (гипогалогеннат)
+3: HCIO2 хлористая (хлорит)
+5: HCIO3, HBrO3, HJO3 галогенноватая (галогеннат)
+7: HCIO4, HBrO4, H5JO6 галогенная (пергалогеннат)
С увелич СО возраст устойчивость и сила к – т и уменьшается их ок – ая способность.
С водородом НF.
Изменение по группе устойчивости соед – ий в высшей со атомов
HCIO4, H Br O4, и HCIO3, H Br O3 – сильные н – ты
HCIO2, H Br O, HJO и H5JO6 слабые к - ты
HCIO и HCIO2 – сильные ок – ли, но неустойчивы
Хар – р хим. связей в соед – ях.
В соед – я образуют хим связи:
а) ковал неполяр: F2, CI2 и т. д.
б) ковал полярна: HF, HJ, … SF6.
в ионная: Zn CI2, Fe CI2, CaF2
Признаки металличности у йода
Ме – ий блеск (блестящие серо – черные кристаллы)
Особенности фтора.
- наименьший радиус
- наибольший потенциал ионизации и ЭО
- огранич. возможности валентности и ст. ок-я., т. о., м. б. только ок-лем.
- хим. связь в м – ле фтора менее прочна, но более жестка.
- невысокая прочность => высок. хим актив – ть.
- невысокое сродство к эл-ну.
2р – орбитали в атоме F сильнее притянуты к ядру и лежат глубже полностью заполненной эл – нами некайносимметричной 2S орбитали. Последняя будучи полностью заселенной, отталкивает присоединяемый атом фтора эл – н, уменьшая эл-ое сродство и увеличивая ионизацион. потенциалы => эф – т обратного экранирования.
