
- •Т. И. Макрушина, а. Л. Верещагин,
- •Растворы
- •071900, 171200, 17150, 230100, Изучающих
- •Введение
- •1 Теоретическая часть
- •Классификация растворов
- •1.2 Общие свойства растворов
- •1.3 Химическое равновесие в растворах
- •1.3.4 Механизм электролитической диссоциации ионных веществ.
- •1.3.5 Механизм электролитической диссоциации полярных веществ
- •1.4 Термодинамика процессов растворения
- •1.5 Теория кислот и оснований
- •Для описания кислотно-основных равновесий в водных растворах применяют классическую теорию Аррениуса. Теория электролитической диссоциации с. Аррениус содержит следующие положения:
- •1.6 Слабые электролиты
- •1.7 Растворы сильных электролитов
- •1.8 Неэлектролиты
- •1.9 Способы выражения концентрации растворов
- •1.10 Методы расчёта заданных концентраций
- •2 Экспериментальная часть
- •2.1 Цель работы
- •2 .2 Мерная химическая посуда
- •Методика проведения работы
- •2.4 Определение концентраций заданных растворов
- •3 Техника безопасности
- •4 Контрольные вопросы на допуск к лабораторной работе
- •5 Карточки для защиты лабораторной работы
- •Основные термины и определения
- •Подготовка к защите лабораторной работы
- •Приложение б Тесты по теме «Растворы»
- •Приложение в
- •В.2 Пример компьютерного отчета
- •Приложение г Основные термины и определения
- •Содержание
- •Введение 4
2 Экспериментальная часть
2.1 Цель работы
Научиться: готовить растворы заданной концентрации
производить пересчёты концентраций растворов
2 .2 Мерная химическая посуда
Мерной называют посуду, применяемую для измерения объёмов жидкости. К ней относятся: цилиндры, пипетки, бюретки, мерные колбы.
При измерении объёмов необходимо, чтобы глаз наблюдателя находился на одной горизонтальной линии с нижним краем мениска жидкости. Нижний край мениска жидкости должен быть на одном уровне с меткой. На рисунке 4, цифрой 2 показано правильное положение наблюдателя, цифрами 1 и 3 – неправильное.
Мерный цилиндр (рисунок 5 a) применяют в тех случаях, когда измерение жидкости не требует большой точности. Мерные цилиндры – стеклянные сосуды с нанесёнными на наружной стенке мерками, указывающими объём в миллилитрах. Вместимость цилиндров бывает от 5…10 мл до 1 л и больше. Чтобы отмерить нужный объём жидкости, её наливают в мерный цилиндр до тех пор, пока нижний край мениска не достигнет уровня нужного деления.
Пипетки (рисунок 5 б) служат для отмеривания и переноса определённого объёма жидкости. Обычные пипетки представляют собой стеклянные трубки небольшого диаметра с расширением на середине. Нижний конец пипетки слегка оттянут и имеет диаметр около 1 мм. Пипетки бывают вместимостью от 1 до 100 мл. В верхней части пипетки имеется метка, до которой набирают жидкость. Широко применяют также градуированные пипетки с делениями (рисунок 5 в).
Бюретки позволяют точно отмерить любой объём жидкости в пределах её вместимости.
Объёмные бюретки (рисунок 5 г) представляют собой стеклянные градуированные трубки, снабженные притёртым краном или стеклянным капилляром, присоединённым к бюретке с помощью резиновой трубки. Внутрь резиновой трубки закладывают стеклянную
бусинку, закрывающую выход жидкости из бюретки. При оттягивании резиновой трубки от бусины внутри неё образуется зазор для вытекания жидкости.
Мерные колбы (рисунок 5 д) применяют для приготовления заданного объёма раствора. Они представляют собой плоскодонные сосуды различной вместимости. На горлышке колбы имеется метка, а на самой колбе указана её вместимость в миллилитрах при определённой температуре.
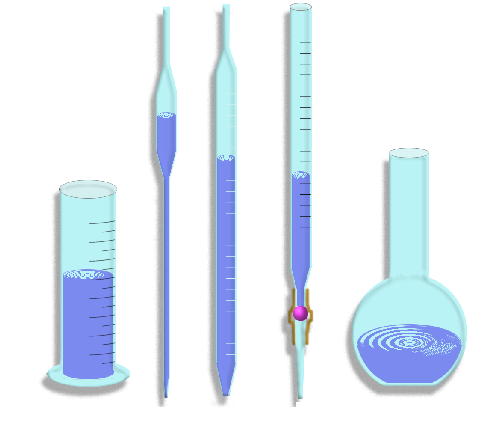
а б в г д
а – мерный цилиндр; б – пипетка; в – градуированная пипетка;
г – объёмные бюретки; д – мерные колбы
Рисунок 5 – мерная посуда
Методика проведения работы
Для ускорения растворения вещество рекомендуется измельчить в фарфоровой ступке. Так как часть вещества при этом может быть потеряна, то измельчение необходимо проводить до взвешивания. Не рекомендуется измельчать вещества гигроскопические (чем больше удельная поверхность такого вещества, тем интенсивнее идёт поглощение). Поэтому их растворяют в том виде, как они есть, раздробив только большие куски.
Следует отметить также, что точную навеску при использовании гигроскопичных веществ взять нельзя (из-за непрерывного поглощения влаги из воздуха стрелка весов «плывёт»).
В этом случае поступают следующим образом: на технических весах быстро взвешивают немного больше расчётной массы вещества, затем вещество растворяют в воде, определяют концентрацию полученного раствора и разбавляют до заданного значения.
Иногда тонко измельчённое вещество плохо смачивается водой и плавает на её поверхности. В этом случае рекомендуется порошок сначала смочить чистым спиртом (этиловым или метиловым), а затем приливать воду.
Растворимость многих веществ увеличивается с повышением температуры. Подогревание можно проводить на газовой горелке или электрической плитке (на асбестовой сетке) при непрерывном помешивании, т. к. осевшее вещество даёт местный прогрев, что может привести к выбросу смеси из сосуда, растрескиванию посуды.
При приготовлении раствора из сухих солей взвешивают расчетное количество вещества (навеску) в чистом сухом бюксе или на часовом стекле. Затем навеску высыпают в стакан, и бюкс (часовое стекло) несколько раз ополаскивают заранее отмеренным количеством воды. Оставшуюся воду выливают в стакан и перемешивают раствор до полного растворения соли. При смешивании растворов (или разбавлении) отмеренное количество исходных растворов выливают в стакан и обязательно перемешивают.
Для приготовления растворов с концентрацией менее 1 % соответствующую навеску вещества растворяют в 100 мл воды. Например: если готовят 0,5 %-ный раствор, то 0,5 г вещества растворяют в 100 мл воды, а не в 99,5 мл, что приводит практически к несущественной ошибке. Следует прилить в стакан (колбу) с отвешенным веществом сначала часть отмеренной воды. И только после полного растворения навески добавить остальную воду.
2.3.1 Варианты заданий
Приготовить 100 мл раствора вещества А концентрации % из безводной соли.
Приготовить 100 мл раствора вещества А концентрации % из кристаллогидрата.
Приготовить 100 мл раствора вещества А концентрации % из раствора концентрации 1% (%<1%).
Пересчитать полученные концентрации растворов из массовых долей в процентах в нормальные и молярные концентрации.
Рассчитать, сколько нужно взять безводной соли (кристаллогидрата) и раствора вещества А концентрацией 1%, чтобы приготовить V мл раствора концентрацией % (%>1%).
Таблица 1 – Таблица экспериментальных данных
Наименование раствора |
Концентрация раствора |
Плотность раствора |
Погрешность |
||||
расчетная |
опытная |
теоретическая |
опыт-ная |
% |
|||
%, масс |
М |
Н |
%, масс |
||||
1. 2. 3. |
|
|
|
|
|
|
|
