
- •Т. И. Макрушина, а. Л. Верещагин,
- •Растворы
- •071900, 171200, 17150, 230100, Изучающих
- •Введение
- •1 Теоретическая часть
- •Классификация растворов
- •1.2 Общие свойства растворов
- •1.3 Химическое равновесие в растворах
- •1.3.4 Механизм электролитической диссоциации ионных веществ.
- •1.3.5 Механизм электролитической диссоциации полярных веществ
- •1.4 Термодинамика процессов растворения
- •1.5 Теория кислот и оснований
- •Для описания кислотно-основных равновесий в водных растворах применяют классическую теорию Аррениуса. Теория электролитической диссоциации с. Аррениус содержит следующие положения:
- •1.6 Слабые электролиты
- •1.7 Растворы сильных электролитов
- •1.8 Неэлектролиты
- •1.9 Способы выражения концентрации растворов
- •1.10 Методы расчёта заданных концентраций
- •2 Экспериментальная часть
- •2.1 Цель работы
- •2 .2 Мерная химическая посуда
- •Методика проведения работы
- •2.4 Определение концентраций заданных растворов
- •3 Техника безопасности
- •4 Контрольные вопросы на допуск к лабораторной работе
- •5 Карточки для защиты лабораторной работы
- •Основные термины и определения
- •Подготовка к защите лабораторной работы
- •Приложение б Тесты по теме «Растворы»
- •Приложение в
- •В.2 Пример компьютерного отчета
- •Приложение г Основные термины и определения
- •Содержание
- •Введение 4
1.3 Химическое равновесие в растворах
Значительная часть процессов, протекающих в растворах, являются равновесными или стремятся к состоянию равновесия.
Раствор, в котором устанавливается равновесие между растворителем и растворенным веществом, называется насыщенным, а концентрация такого раствора – растворимостью. Растворы с меньшей концентрацией называются ненасыщенными:
растворение
Р
 астворяемое
вещество Раствор .
астворяемое
вещество Раствор .
образование фазы
Растворимость зависит от температуры. Можно приготовить пересыщенный раствор медленным охлаждением раствора, полученного при повышенной температуре. У пересыщенного раствора равновесие метастабильно и любое физическое воздействие приводит к выпадению осадка.
Растворимость для различных веществ колеблется в значительных пределах и зависит от их природы, от взаимодействия частиц растворённого вещества между собой и с молекулами растворителя, а также от внешних условий (температуры, давления).
Предсказать растворимость трудно, но некоторые закономерности есть:
1) подобное растворяется в подобном. Неполярные вещества (кислород, галогены) – хорошо растворяются в неполярных растворителях, в воде – плохо; в воде хорошо растворяются полярные вещества;
2) высокая растворимость может быть следствием образования водородных связей (спирт-вода).
1.3.1 Растворимость газов в жидкостях
Растворение газа в жидкости - процесс экзотермический, с ростом температуры растворимость уменьшается (принцип Ле Шателье). Растворимость газов пропорциональна их парциальным давлениям - закон Генри.
1.3.2 Растворимость жидкостей в жидкостях может быть полной (спирт-вода), ограниченной (вода-анилин). Растворимость жидкости в жидкости растет с температурой и при некоторой критической температуре наблюдается полная взаимная растворимость.
1.3.3 Растворимость твердых веществ в жидкостях
Растворимость твердых веществ в жидкостях увеличивается с увеличением температуры, давление практически не влияет. Добавки посторонних веществ снижают растворимость данного вещества - меньше свободных молекул растворителя (эффект высаливания).
Скорость растворения твердых веществ зависит от их дисперсности – измельченный порошок растворяется быстрее первоначального продукта.
На кафедре неорганической химии С.-Петербургского университета, которую возглавлял с 1934 по 1977 г. С.А.Щукарев, проводились термохимические исследования растворов электролитов и твердых фаз. В соответствии с законом С.А.Щукарева, скорость процесса кристаллизации и обратного процесса растворения определяется скоростью подвода или отвода вещества к поверхности кристалла и описывается уравнением:
![]() ,
(1.9)
,
(1.9)
где - коэффициент массоотдачи;
Cp- концентрация насыщения;
C- концентрация пересыщения;
F - поверхность кристалла.
Сольватация – взаимодействие между молекулами и ионами растворяемого вещества и молекулами растворителя состоит из нескольких стадий: молекулярная диссоциация, образование сольватов, ионизация и электролитическая диссоциация:
![]() ,
стадия(a) -
процесс образования сольватов
,
стадия(a) -
процесс образования сольватов
где АВ – молекулы растворяемого вещества;
S – молекулы растворителя.
![]() ,
стадия(b) -
электролитическая диссоциация.
,
стадия(b) -
электролитическая диссоциация.
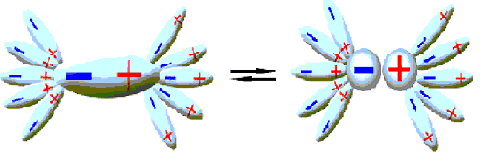
Рисунок 2 – Процесс образования сольватов
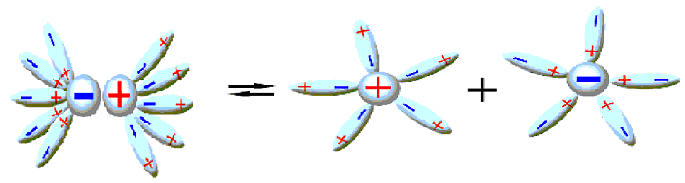
Рисунок 3 – Электролитическая диссоциация
Если процесс сольватации останавливается на стадии (a), то образуется раствор неэлектролита (подчиняется законам Рауля, Вант – Гоффа: раствор сахара в воде).
Если процесс протекает до стадии (b), то система является раствором электролита: растворы щелочей, солей, неорганических кислот в воде.
