
- •Предмет, задачі та методи молекулярної фізики.
- •Основи молекулярно-кінетичної теорії будови речовини. Положення.
- •Маса атомів і молекул. Одинична атомна маса. Відносна атомна або молекулярна маса. Кількість речовини.
- •Основні положення молекулярно-кінетичної теорії газів.
- •Тиск газу. Основне рівняння молекулярно-кінетичної теорії газів.
- •Температура. Термодинамічна рівновага. Релаксація; час релаксації. Нульовий закон термодинаміки. Співвідношення між термодинамічною температурою та одиницями енергії. Стала Больцмана.
- •Підтвердження молекулярно-кінетичної теорії : Броунівський рух, дифузія, молекулярні пучки.
- •Рівняння стану ідеального газу. Рівняння Клайперона. Молярна газова стала r. Фізичний зміст.
- •Закон Бойля-Маріотта. Коефіцієнт стисливості.
- •Закон Гей-Люссака. Коефіцієнт об’ємного розширення газу.
- •Закон Шарля. Термічний коефіцієнт тиску.
Основні положення молекулярно-кінетичної теорії газів.
Для газів характерні великі міжмолекулярні відстані, малі сили притягання, тому гази можуть необмежено розширюватись. Молекули газу хаотично рухаються, співударяються одна з одною і зі стінками посудини
Для пояснення властивостей речовини в газоподібному стані в фізиці введемо модель ідеального газу.
Ідеальний
газ -
це газ, в якому молекули можна вважати
матеріальними точками, а силами притягання
й відштовхування між молекулами можна
знехтувати. У природі такого газу не
існує, але близькими за властивостями
можна вважати реальні розріджені гази,
тиск в яких не перевищує 200 атм і які
перебувають при не дуже низькій
температурі, оскільки відстань за таких
умов між молекулами набагато перевищує
їх розміри. Нехай всередині посудини,
площа стінки якої S міститься
ідеальний одноманітний газ з молекулами
масою m0 кожна,
які хаотично рухаються зі швидкостями ![]() .
.
Загальна
кількість молекул в посудині N,
а через ![]() позначимо
середню квадратичну швидкість їх руху;
позначимо
середню квадратичну швидкість їх руху;
Свойства идеального газа на основе молекулярно-кинетических представлений определяются исходя из физической модели идеального газа, в которой приняты следующие допущения:
объём частицы газа равен нулю (то есть, диаметр молекулы
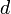 пренебрежимо
мал по сравнению со средним расстоянием
между ними,
пренебрежимо
мал по сравнению со средним расстоянием
между ними, 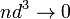 ) [1];
) [1];импульс передается только при соударениях (то есть, силы притяжения между молекулами не учитываются, а силы отталкивания возникают только при соударениях);
суммарная энергия частиц газа постоянна (то есть, нет передачи энергии за счет передачи тепла или излучения)
Тиск газу. Основне рівняння молекулярно-кінетичної теорії газів.
![]()
Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) газовой системы с микроскопическими (масса молекул, средняя скорость их движения).
Температура. Термодинамічна рівновага. Релаксація; час релаксації. Нульовий закон термодинаміки. Співвідношення між термодинамічною температурою та одиницями енергії. Стала Больцмана.
Температу́ра (від лат. temperatura — належне змішування, нормальний стан) — фізична величина, яка описує здатність макроскопічної системи (тіла), що знаходиться в стані термодинамічної рівноваги, до передачі тепла іншим тілам.
Позначається літерою T або t.
На побутовому рівні температура пов'язана із суб'єктивним сприйняттям «тепла» і «холоду». Теплі тіла мають більшу температуру, холодні — меншу. В розумінні сучасної фізики температура пов'язана з тепловим рухом атомів та молекул.
Температура відіграє важливу роль у багатьох галузях науки, включаючи фізику, хімію і біологію
Властивості
В стані рівноваги температура має однакове значення для всіх макроскопічних частин системи. Якщо в системі два тіла мають однакову температуру, то між ними не відбувається передачі тепла. Якщо існує різниця температур, то тепло переходить від тіла з вищою температурою до тіла з нижчою.
На мікроскопічному рівні температура пов'язана із тепловим рухом атомів та молекул, із яких складаються фізичні тіла, а саме — з їх кінетичною енергією.
Температу́ра — скалярна фізична величина, яка характеризує середню кінетичну енергію частинок макроскопічної системи, що припадає на одну ступінь свободи, що перебуває в станітермодинамічної рівноваги. Температу́ра (від лат. temperatura — належне змішування, нормальний стан) — скалярна фізична величина, яка характеризує середню кінетичну енергію частинок макроскопічної системи, що припадає на одну ступінь свободи, що перебуває в стані термодинамічної рівноваги.[1]
Рівнова́га термодинамі́чної систе́ми — стан, при якому термодинамічна система займає певний об'єм, і перебуває у рівноважному стані (стані рівноваги). Такий стан є тоді, коли тиск,температура і хімічний склад системи в усіх її частинах, якими малими вони б не були, є однаковими.
Процес встановлення рівноваги в термодинамічній системі складний і загалом включає в себе декілька стадій. Якщо сполучити між собою дві різні системи загалом з різним хімічним складом, температурою і тиском, то перш за все встановлюється рівновага тиску. Наступним за швидкістю процесом є встановлення температурної рівноваги. Встановлення рівноваги за складом може відбуватися дуже довго. Наприклад, у випадку дифузії в твердих тілах. Тому часто про рівноважні системи говорять, що в них уже відбулися всі швидкі процеси, а всі повільні процеси ще не завершилися.
Релаксація (рос. релаксация; англ. relaxation; нім. Relaxation f, Ermüdung f) – процес зменшення величини збурення у фізичній системі завдяки дисипації енергії, поступовий перехід фізичної системи до стану рівноваги. Часто характеризується часом релаксації.
1) Процес поступового переходу фізичної чи фізико-хімічної системи з нерівноважного стану, спричиненого зовнішніми впливами, у стан термодинамічної рівноваги або в певний стаціонарний стан. До релаксації належать: вирівнювання концентрації розчиненої речовини в розчині після того, коли вона вся розчинилася; розряджання електричного конденсатора тощо. Характеризують різні види релаксації часом її перебігу.
2) Процес зменшення напружень у часі внаслідок теплового руху при незмінних зовнішніх умовах і розмірах тіла. Час, протягом якого напруга зсуву в тілі зменшиться в е разів (е = 2,71828...), називається періодом релаксації і позначається θ: θ = µ / κ, де µ – динамічний коефіцієнт в’язкості рідини; κ – модуль пружності; ε – деформація. Якщо τ – час дії сили на тіло, більший за період релаксації (τ >θ), то тіло – рідина, якщо навпаки (τ<θ), то тіло – тверде.
Релаксація (рос. релаксационный, англ. relaxation, relaxational, нім. relaxatisch, Relaxations…) – пов’язаний з релаксацією; р е л а к с а ц і й н і к о л и в а н н я – автоколивання, які за формою (графіком) дуже відрізняються від синусоїдальних (гармонічних) коливань завдяки тому, що в системах, де вони відбуваються, істотну роль відіграють дисипативні сили (тертя,в’язкість – у механічних системах, активний опір – у електричних системах).
Нульовий закон термодинаміки. ---------- ?????
Ста́ла Бо́льцмана (k або kB) — фізична стала, що визначає зв'язок між температурою та енергією. Названа на честь австрійського фізика Людвіга Больцмана, який зробив великий вклад встатистичну фізику, у якій ця стала займає ключову позицію. Її експериментальне значення в системі СІ дорівнює
![]() Дж/К[1].
Дж/К[1].
Числа у круглих дужках вказують стандартну похибку в останніх цифрах значення величини. В принципі, сталу Больцмана можна отримати з визначення абсолютної температури та іншихфізичних констант (для цього потрібно вміти розрахувати з перших принципів температуру потрійної точки води). Але визначення сталої Больцмана за допомогою основних принципів занадто складне і нереальне при сучасному розвитку знань у цій галузі.
Стала Больцмана — зайва фізична стала, якщо вимірювати температуру в одиницях енергії, що дуже часто робиться в фізиці. Вона є, власне, зв'язком між добре визначеною величиною — енергією і градусом, значення якого склалося історично.
