
1) Н3ВO3
2) Кислота борная ,Acidum boricum
3) Н3ВО3: получают разложением буры горячим раствором НСl:
Na2B4O7 10H2O + 2 НСl 4 Н3ВО3 + 2 NaСl + 5 H2O
Борную кислоту фильтруют и проводят перекристаллизацию из воды.
4) Описание. Растворимость. Блестящие, жирные на ощупь, бесцветные, прозрачные чешуйчатые кристаллы или мелкий белый кристаллический порошок, без запаха. Плохо растворим в холодной воде, хорошо растворим в горячей воде, растворяется в спирте 1:25 и медленно в глицерине 1:7. Борная кислота возгоняется с парами воды и спирта.
При нагревании кристаллов борной кислоты постепенно теряется вода. При 100 С образуется метаборная кислота, затем - тетраборная кислота, а затем - остаток оксида бора (III). При реагировании с водой все эти соединения снова образуют борную кислоту.
1000 С 1800 С
Н3ВО3 НВО2 H2B4O7 2 В2О3
борная - H2O метаборная - H2O тетраборная - H2O оксид бора
кислота кислота кислота
Водные растворы борной кислоты имеют слабокислую реакцию. При добавлении щелочи образуются соли тетраборной кислоты - тетрабораты или реже метаборной кислоты - метабораты. Соли ортоборной кислоты неизвестны.
5) Подлинность
Н3ВО3: 1) Образование борноэтилового эфира, который горит пламенем, окаймленным зеленым цветом:
 ОН
ОС2Н5
ОН
ОС2Н5

 В –
ОН + 3 С2Н5ОН
+ H2SO4(к.)
В ―ОС2Н5
+ 3 Н2О
В –
ОН + 3 С2Н5ОН
+ H2SO4(к.)
В ―ОС2Н5
+ 3 Н2О
ОН ОС2Н5
2) Реакция с куркумином (кристаллическое вещество желто-оранжевого цвета в спирте): на куркумовую бумагу помещают раствор препарата и НСl, образуется розовая окраска, которая при прибавлении аммиака становится зеленой, а затем черной.
 OCH3
OCH3
OCH3
OCH3

 OH
HO – C – CH = CH– ― OH HO
O – C – CH = CH― ―OH
OH
HO – C – CH = CH– ― OH HO
O – C – CH = CH― ―OH


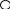
 B
OH + CH →
B
CH
B
OH + CH →
B
CH
OH O = C – CH = CH– – OH HO O = C – CH = CH― ―OH
—OCH3 —OCH3
куркумин розоцианин
3) + ализарин красный S + НСl → желтое окрашивание
Na2B4O7 · 10 H2O: 1) Общие фармакопейные реакции на Na+ в ОФС ГФ.
2) Na2B4O7 + HCl H3BO3 затем проводят все реакции на борную кислоту.
6) Доброкачественность
H3BO3: 1) допустимы: Cl-, SO42-, Ca2+, Fe , т.м., As.
2) недопустимы: минеральные кислоты: препарат растворяют в воде при нагревании,
раствор охлаждают, осадок фильтруют, к фильтрату прибавляют 1 каплю метилового оранжевого; раствор не должен быть розового или оранжевого цвета. Сама кислота борная не меняет окраску этого индикатора, так как очень слабая кислота.
7) Количественное определение
H3BO3 : 1) Алкалиметрия, прямое титрование, среда - смесь 1:4 свежепрокипяченной воды и нейтрализованного по фенолфталеину глицерина. Индикатор – фенолфталеин.
Метод основан на кислотных свойствах растворов борной кислоты в глицерине. Если не добавлять глицерин, то щелочная реакция наступит раньше, так как борная кислота – очень слабая кислота и образующийся в процессе титрования метаборат натрия в водных растворах сильно гидролизуется с образованием щелочи:
H3BO3 + NaOH NaBO2 + 2 H2O
NaBO2 + 2 H2O H3BO3 + NaOH
Поэтому при количественном определении борной кислоты используют её способность образовывать одноосновную комплексную кислоту с глицерином. Диглицериноборная кислота – сильный электролит и точно оттитровывается щелочью.
_ _
СН2ОН НОН2С СН2ОН НОН2С
СН – О – В – О – НС Н + + NaOH СН – О – В – О – НС Na+ + H2O
 СН2
– О О – Н2С
СН2
– О О – Н2С
СН2
– О О – Н2С
СН2
– О О – Н2С
Титруют при комнатной температуре, так как при температуре больше 50о С комплекс разрушается. Избыток глицерина на результаты титрования не влияет. В конце титрования добавляют дополнительную порцию глицерина, чтобы избежать гидролиза натриевой соли диглицероборной кислоты. Если розовая окраска сохранилась после добавления глицерина, то титрование заканчивают, а если окраска исчезает, то титрование продолжают.
2) Комплексонометрия, обратное титрование, среда –аммиачный буфер, избыток трилона Б оттитровывают хлоридом магния, индикатор – КХЧС.
Na2B4O7: Ацидиметрия, прямое титрование, индикатор – метиловый оранжевый. Метод основан на щелочных свойствах водных растворов буры.
8,9) Хранят в хорошо укупоренной таре, в прохладном месте, так как натрия тетраборат может терять кристаллизационную воду и гидролизоваться с образованием борной кислоты
Применяют препараты как антисептики для наружного применения. Борную кислоту применяют в виде 2–3 % растворов для полоскания горла, в виде глицериновых растворов, мазей, присыпок. 1–2 % растворы используют в глазной практике. Соединения бора ядовиты, поэтому внутрь не применяются. Буру применяют в виде 1–2 % растворов.
-
HСI 24,8-25,2 %
HСI 8,2-8,4 %
Кислота хлористоводородная (кислота соляная)
Acidum hydrochloricum
Кислота хлористоводородная разведенная
Acidum hydrochloricum dilutum
Описание. Бесцветные прозрачные жидкости со своеобразным запахом, кислой реакции. Кислота хлористоводородная – летучая жидкость.
Свойства препаратов кислоты соляной очень сходны. Они смешиваются с водой и спиртом во всех соотношениях. Отличаются препараты только по концентрации и соответственно по плотности.
Получение
Промышленный способ получения хлороводорода – это прямой синтез из водорода и хлора. Их предварительно получают при электролизе раствора хлорида натрия:
2 NaС1 + 2 Н2О → 2 NаОН + Н2 ↑ + С12 ↑
При пропускании электрического тока на катоде и аноде происходят следующие процессы: NaCl ↔ Na+ + Cl- Катод Анод
2 Na+ + 2 ê → 2 Nа 2 С1- - 2 ê → 2 С1
2 Nа + 2 Н2О → 2 NаОН + Н2 ↑ 2 С1 → С12 ↑
Полученные водород и хлор сжигают в контактных печах, подавая в горелку одновременно оба газа: Н2 + С12 → 2 НС1
Образующийся хлороводород пропускают через поглотительные башни с водой, в которых образуется хлористоводородная кислота. Этот промышленный способ позволяет получить соляную кислоту высокой степени чистоты с концентрацией 35 – 36 % хлороводорода.
Подлинность
1) Идентифицируют кислоту хлористоводородную по реакции на хлорид-ион с нитратом серебра, образуется нерастворимый в воде и в растворе азотной кислоты, но растворимый в растворе аммиака осадок хлорида серебра: НС1 + AgNO3 → AgС1 ↓ + НNO3
белый
AgС1 + 2 NН4OН → [Ag(NН3)2]С1 + 2 Н2О
2) Кроме того, обнаружение хлорид-иона основано на выделении свободного хлора при нагревании препаратов с окислителем - диоксидом марганца:
2
4 HCl + MnO2 → С12 ↑ + MnС12 + 2 Н2О
Выделившийся хлор можно обнаружить по реакции с калия йодидом и хлороформом:
С12 + 2 KI → I2 + 2 KC1
Таким образом, хлорид-ион проявляет слабые восстановительные свойства и окисляется до молекулярного хлора при действии сильных окислителей.
3) Индикатор метилоранж окрашивается в розовый цвет при прибавлении к соляной кислоте.
Доброкачественность
Недопустимы:
примесь свободного хлора, азотной и азотистой кислот (определяют по реакции с калия йодидом и хлороформом, не должно быть фиолетового окрашивания хлороформного слоя);
кислота сернистая (определяют по реакции с йодом и крахмалом, не должно быть обесцвечивания): H2SO3 + I2 → H2SO4 + 2 HI
SO42- , т.м., As.
Допустимо: Fe3+.
Количественное определение
1) Определение концентрации хлороводорода в препаратах проводят методом нейтрализации, титруя препараты раствором гидроксида натрия в присутствии индикатора метилового оранжевого: HCl + NаОН → NaС1 + Н2О
2) Содержание хлороводорода можно установить аргентометрическим методом.
3) А так же по плотности с помощью таблиц, приведенных в ГФ.
Применение, хранение
В медицине применяют только кислоту соляную разведенную при недостаточной кислотности желудочного сока. Назначают внутрь 2 - 4 раза в день во время еды по 10 - 15 капель на 1/4 — 1/2 стакана воды. Хранят кислоту хлористоводородную в стеклянных банках с притертыми пробками, так как она летуча.
KCl |
Калия хлорид Kalii chloridum |
Описание. Растворимость. Белые кристаллы или белые кристаллические порошки без запаха, соленого вкуса. Растворимы в 3 ч воды, мало растворимы в спирте. Реакция раствора нейтральная. Так как это соли сильной кислоты и сильного основания не подвергаются гидролизу.
3
