
§5. Твердые тела.
Кристаллические и аморфные тела
В отличие от жидкостей твердые тела обладают упругостью формы. При всяких попытках изменить геометрию твердого тела в нем возникают упругие силы, препятствующие этому воздействию. Исходя из особенностей внутренней структуры твердых тел, различают кристаллические и аморфные твердые тела. Кристаллы и аморфные тела существенно различаются между собой по многим физическим свойствам.
Аморфные тела по своей внутренней структуре очень напоминают жидкости, поэтому их часто называют переохлаждёнными жидкостям. Как и жидкости, аморфные тела структурно изотропны. Их свойства не зависят от рассматриваемого направления. Объясняется это тем, что в аморфных телах, так же, как и в жидкостях сохраняется ближний порядок (координационное число), а дальний (длины и углы связей) отсутствует. Этим и обеспечивается полная однородность всех макрофизических свойств аморфного тела. Типичными примерами аморфных тел являются стекла, смолы, битумы, янтарь.
Кристаллические тела, в отличие от аморфных, имеют четкую упорядоченную микроструктуру, которая сохраняется на макроуровне и проявляется внешне в виде мелких зерен с плоскими гранями и острыми ребрами, называемых кристаллами.
Распространенные в природе кристаллические тела (металлы и сплавы, сахар и поваренная соль, лед и песок, камень и глина, цемент и керамика, полупроводники и т д) обычно являются поликристаллами, состоящими из хаотично ориентированных, сросшихся между собой монокристалликов (кристаллитов), размеры которых составляют около 1 мкм (10-6 м) Однако иногда встречаются монокристаллы достаточно больших размеров. Например, монокристаллы горного хрусталя достигают человеческого роста В современной технике монокристаллы играют важную роль, поэтому разработана технология их искусственного выращивания.
Внутри монокристалла атомы (ионы) вещества размещаются с соблюдением дальнего порядка, в узлах четко ориентированной в пространстве геометрической структуры, получившей название кристаллической решётки Каждое вещество образует в твердом состоянии свою, индивидуальную по геометрии кристаллическую решётку. Ее форма определяется структурой молекул вещества. В решетке всегда может быть выделена элементарная ячейка, сохраняющая все её геометрические особенности, но включающая в себя минимально возможное число узлов.
Монокристаллы каждого конкретного вещества могут иметь разные размеры. Однако все они сохраняют одинаковую геометрию, которая проявляется в сохранении постоянных углов между соответствующими гранями кристалла. Если форма монокристалла будет принудительно нарушена, то он при последующем выращивании из расплава или просто при нагревании обязательно восстанавливает свою прежнюю форму. Причиной такого восстановления формы кристалла является известное условие термодинамической устойчивости - стремление к минимуму потенциальной энергии. Для кристаллов это условие сформулировано независимо друг от друга Дж У. Гиббсом, П Кюри и Г. В. Вульфом в виде принципа: поверхностная энергия кристалла должна быть минимальной.
Одной из наиболее характерных особенностей монокристаллов является анизотропия их многих физико-механических свойств. Например, твердость, прочность, хрупкость, тепловое расширение, скорость распространения упругих волн, электропроводность и теплопроводность многих кристаллов могут зависеть от направлений в кристалле. В поликристаллах анизотропия практически не проявляется только из-за хаотичной взаимной ориентации образующих их мелких монокристалликов. Она связана с тем, что в кристаллической решетке расстояния между узлами в различных направлениях в общем случае оказываются существенно разными.
Другой важной особенностью кристаллов можно считать то, что они плавятся и кристаллизуются при постоянной температуре, в полном соответствии с термодинамической теорией фазовых переходов первого рода. У аморфных твердых тел четко выраженный фазовый переход отсутствует. При нагревании они размягчаются плавно, в широком интервале изменения температуры Это означает, что у аморфных тел нет определённой регулярной структуры и при нагревании она разрушается поэтапно, тогда как кристаллы при нагревании разрушают однородную кристаллическую решетку (с её дальним порядком) строго при фиксированных энергетических условиях, а следовательно, и при фиксированной температуре.
Некоторые твёрдые вещества способны существовать устойчиво как в кристаллическом, так и в аморфном состояниях. Характерным примером может служить стекло. При достаточно быстром охлаждении расплава стекло становится очень вязким и затвердевает, не успевая приобрести кристаллическую структуру. Однако при очень медленном охлаждении, с выдержкой на определённом температурном уровне то же самое стекло кристаллизуется и приобретает специфические свойства (такие стёкла называют ситаллами). Другим типичным примером является кварц. В природе он обычно существует в виде кристалла, а из расплава всегда образуется аморфный кварц (его так и называют плавленым кварцем). Опыт показывает, что чем сложнее молекулы вещества и чем сильнее их межмолекулярные связи, тем легче при остывании получить твердую аморфную модификацию.
Типы химических связей в кристаллах
Различают четыре основных типа химических связей, которые встречаются в кристаллах.
1. Гомеополярная (однополярная) ковалентная связь. Она обычно возникает при взаимодействии двух металлоидов, сопровождается обобществлением в молекуле вещества внешних, валентных электронов, что приводит к увеличению плотности электронов в области пространства между ядрами атомов, образующих молекулу. Увеличение электронной плотности усиливает притяжение ядер к этим электронам и, как следствие, обеспечивает связь между ядрами. Примером такой связи является ZnS.
2. Гомеополярная металлическая связь. Она возникает во всех металлах (Ni, Fe и т. д.) и отличается от ковалентной прежде всего тем, что металлы имеют атомарную структуру и в их кристаллической решетке внешние, валентные электроны полностью обобществляются в объёме всего кристалла. Металлическая связь в результате оказывается гораздо более сильной, нежели ковалентная, поэтому и выделяет их по многим физико-механическим свойствам в особую группу. Благодаря свободным электронам, металлы являются проводниками тока.
Гетерополярная (разнополярная) ионная связь. Она возникает между металлом и металлоидом, например в NaCl, KC1 и т. п. При такой связи в узлах решетки чередуются положительные и отрицательные ионы атомов, образующих молекулу.
Молекулярная связь. Связь такого типа обусловлена вандерваальсовскими силами, которые складываются из трех составляющих дисперсионной, индуцированной и ориентационной. Каждая из них имеет электромагнитную природу, но находит объяснение только в рамках квантовой физики.
Типы кристаллических решёток.
С
Рис. 8.5.1. Элементарная
ячейка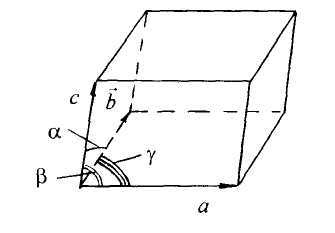
Элементарная
ячейка всегда представляет собой
параллелепипед, построенный
на трёх векторах
![]() (рис.
8.5.1).
(рис.
8.5.1).
Модули
этих векторов совпадают с периодом
повторяемости (идентичности).
Направления рёбер ячейки характеризуются
углами
![]() ,
которые
образуются между ребрами Значения
,
которые
образуются между ребрами Значения
![]() однозначно определяют
элементарную ячейку кристалла, поэтому
называются ее параметрами.
однозначно определяют
элементарную ячейку кристалла, поэтому
называются ее параметрами.
Для характеристики и классификации кристаллов пользуются понятием решётки Браве. В общем случае решётка Браве объединяет в кристалл не все частицы данного сорта, а только те из них, которые одинаково расположены. Следовательно, реальная кристаллическая решетка может состоять из нескольких вдвинутых одна в другую решеток Браве Например, кристалл NaCl состоит из двух решеток Браве, одна из которых объединяет узлы ионов Na+, а другая - ионов Cl-.
Если кристаллическую решетку конкретного кристалла образует только одна решетка Браве, то каждая элементарная ячейка кристалла содержит по одной частице. В общем случае элементарная ячейка содержит столько частиц, сколько решеток Браве в кристалле.
Все решетки Браве обладают трансляционной симметрией и при этом могут иметь различные оси и плоскости симметрии. Всего существует 14 разных типов решеток Браве, которые образуют 7 систем симметрии, называемых кристаллографическими системами или сингониями. Выдающийся русский кристаллограф Е С Федоров в 1890 г доказал, что в природе могут наблюдаться 230 различных по геометрии кристаллических решеток (пространственных групп), которые объединяют по признакам симметрии в 32 класса Структура любого кристалла в первом приближении может быть одной из решёток Браве
Перечислим основные характеристики 7 сингоний:
триклинная (
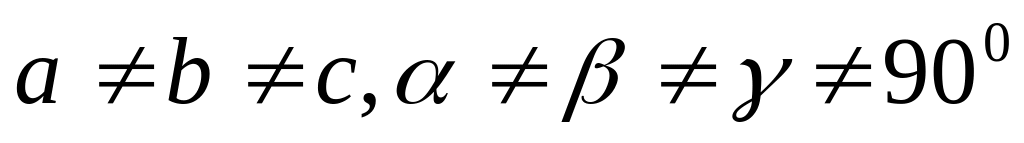 ,
одна
решетка Браве),
,
одна
решетка Браве),моноклинная (
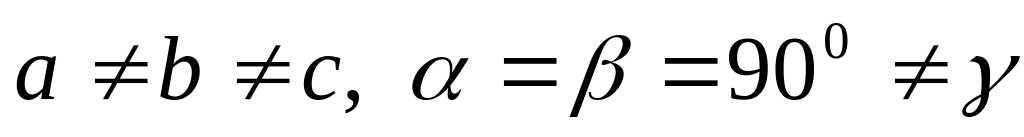 ,
две решетки Браве),
,
две решетки Браве),ромбическая (
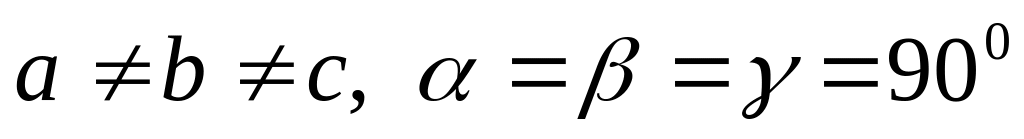 ,
четыре решетки Браве),
,
четыре решетки Браве),ромбоэдрическая (
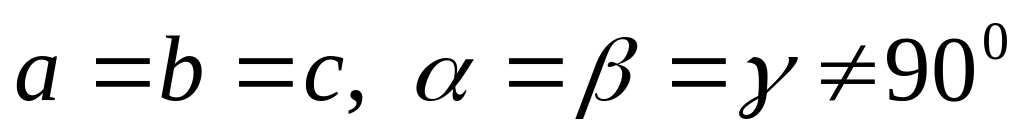 ,
одна решетка Браве),
,
одна решетка Браве),гексагональная (
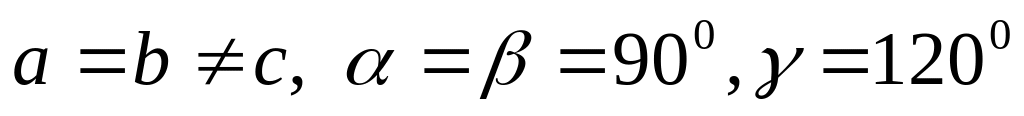 ,
одна решетка Браве),
,
одна решетка Браве),тетрагональная (
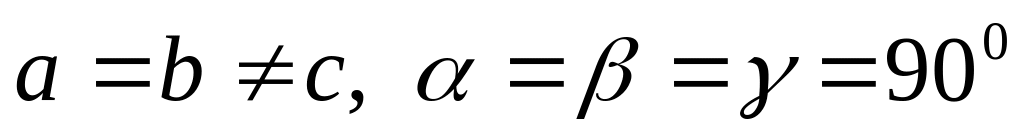 ,
две решетки Браве),
,
две решетки Браве),кубическая (
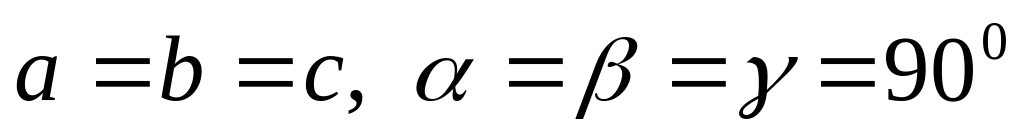 ,
три решетки Браве).
,
три решетки Браве).
Одно и то же вещество способно иметь несколько типов кристаллических решёток. Примером могут служить кристаллы алмаза и графита, исходным веществом которых является углерод. Решетка алмаза принадлежит к кубической кристаллографической системе (тетраэдр), а у графита - к гексагональной (шестиугольной) системе.
Различные кристаллические структуры одного и того же вещества называются его полиморфными формами (модификациями), а фазовый переход вещества из одной модификации в другую - полиморфным превращением. Такого рода превращения удовлетворяют всем признакам фазовых переходов первого рода.
