
- •Выбор режима
- •Калибровка рН-метра по стандартным растворам рН. Определение рН водопроводной и дистиллированной воды
- •Установка титра щелочи по стандартному раствору соляной кислоты
- •Определение ступенчатых констант кислотности фосфорной кислоты по кривой ее алкалиметрического титрования
- •Введение
- •1.Описание и работа
- •1.1. Назначение и область применения
- •1.2. Устройство анализаторов
- •1.3.Структурная схема измерительного преобразователя
- •1.4. Электродные системы (эс)
- •1.5. Температурный датчик
- •1.6. Датчик кислорода
- •1.7. Органы управления анализатором
- •2. Использование по назначению
- •2.1. Особенности эксплуатации
- •2.2. Использование анализаторов
- •2.3 Ионометрические измерения рХ (pH) в режиме «рН-метр-иономер» на одноканальных анализаторах (один измерительный электрод) c термокомпенсацией
- •2.3.1. Просмотр ранее внесенных память прибора градуировок.
- •2.3.2. Калибровка рН-метра по буферным растворам.
- •2.2.3. Выполнение измерений.
рН-метрия со стеклянным электродом и кислотно-основное титрование
Введение.
рН-метрией называют метод прямого потенциометрического определения водородного показателя рН, равного отрицательному логарифму молярной активности иона водорода в растворе.
«Традиционная» измерительная ячейка состоит из индикаторного стеклянного рН-электрода, хлорид-серебряного электрода сравнения и температурного датчика. Все три этих компонента могут физически находиться в одном корпусе и быть составляющими комбинированного рН-электрода. Для защиты электрода при измерении рН на той или иной стадии производства используют специальные защитные корпуса. Полученный сигнал передается в трансмиттер, отображается на дисплее и передается на ЦПУ.
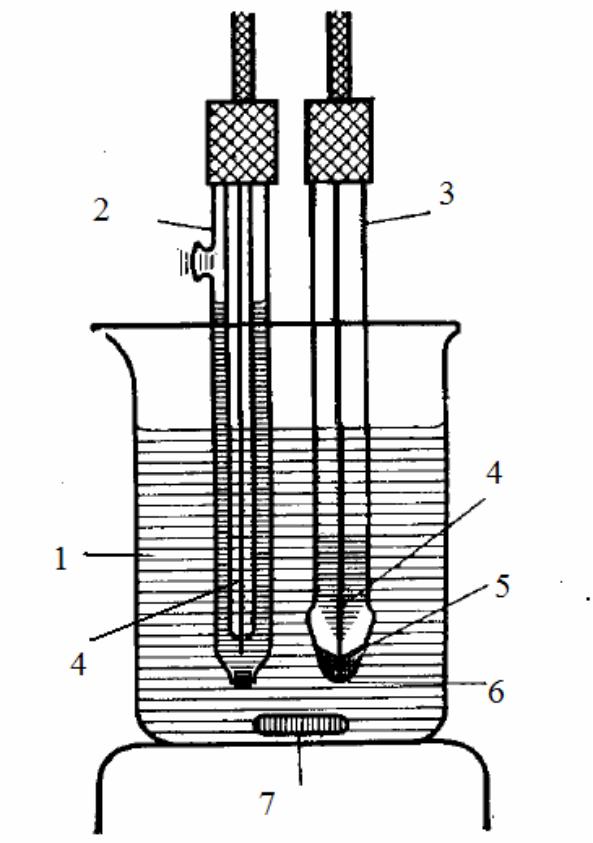
Рис. 1. Схема ячейки для измерения со стеклянным электродом:
1 – раствор с неизвестным рН; 2 – хлорид-серебряный электрод сравнения; 3 – стеклянный электрод; 4 – серебряная проволока, покрытая твердым AgCl; 5 – 0,1 М раствор HCl насыщенный AgCl; 6 – чувствительная стеклянная мембрана; 7 – магнитная мешалка.
Эквивалентная схема электролитической ячейки имеет вид:

ЭДС ячейки складывается из падения потенциала на ее элементах:
E = E2 – E1 + 1 – 2. (1)
Где Е1 и Е2 – потенциалы внутреннего и внешнего хлорид-серебряных электродов,
1 и 2 – потенциалы на внешней и внутренней поверхности стеклянной мембраны.
Для изготовления стеклянных мембран используются специальные сорта стекла, например, состава 22% Na2O, 0,6% CaO, 72% SiO2. Ионы натрия и кальция легко обмениваются, при вымачивании электрода в кислоте, на ионы водорода так, что поверхность стекла покрывается тончайшим слоем геля метакремниевой кислоты. Стекло приобретает электродную функцию благодаря двухфазному равновесию:
HGI(тв) ⇄ H+(р-р) + GI–(тв) (2)
На поверхности мембраны возникает потенциал, который при равновесии подчиняется уравнению Нернста:
![]() (3)
(3)
Поскольку в уравнении (1.1) все величины постоянны, кроме 1, то при подстановке (1.2) в (1.1) и объединении всех постоянных имеем:
![]() (4)
(4)
Уравнение (1.4) является основой для рН-метрии со стеклянным электродом.
Перед началом измерения рН новый стеклянный электрод должен быть выдержан не менее суток в 0,1 М растворе НС1 или в дистиллированной воде. А рН-метр настраивают по стандартным буферным растворам. Промышленность выпускает стандарт–титры для приготовления образцовых буферных растворов для рН-метрии (фиксаналов), см. табл. 1. рН этих растворов указан в паспорте фиксаналов для стандартной температуры, равной 25С.
Таблица 1. Первичные стандарты рН (25С)
№ буфера |
Состав буфера |
рН |
1 |
Битартрат калия (нас.) |
3,557 |
2 |
Бифталат калия (0,05 М) |
4,008 |
3 |
KH2PO4 (0,025 M) и Na2HPO4 (0,025 M) |
6,865 |
4 |
KH2PO4 (0,0087 M) и Na2HPO4 (0,030 M) |
7,413 |
5 |
Тетраборат натрия (0,01 М) |
9,180 |
р Н
стандартного раствора является сложной
функцией температуры. При изменении
температуры может изменяться концентрация
ионов водорода за счет изменения констант
протолиза компонентов буферной смеси
и изменения объема раствора. Кроме того,
как следует из теории Дебая – Гюккеля,
температура влияет на коэффициенты
активности ионов. Поэтому градуирование
прибора по стандартам и измерения рН
испытуемых растворов следует выполнять
при одинаковой температуре (при
термостатировании) для обеспечения
большей точности анализа. От температуры
зависят не только активность
потенциалобразующего иона Н+,
но также параметры электродной функции
ион-селективного электрода (3):
Е = Е0(Т) – S(T)pH.
При изменении температуры может
изменяться свободный член уравнения
(стандартный потенциал), т.к. он связан
с константой распределения иона водорода
между фазой мембраны и раствором.
Коэффициент наклона
S(T)
≈ 2,3RT/F
можно считать явной функцией температуры.
Н
стандартного раствора является сложной
функцией температуры. При изменении
температуры может изменяться концентрация
ионов водорода за счет изменения констант
протолиза компонентов буферной смеси
и изменения объема раствора. Кроме того,
как следует из теории Дебая – Гюккеля,
температура влияет на коэффициенты
активности ионов. Поэтому градуирование
прибора по стандартам и измерения рН
испытуемых растворов следует выполнять
при одинаковой температуре (при
термостатировании) для обеспечения
большей точности анализа. От температуры
зависят не только активность
потенциалобразующего иона Н+,
но также параметры электродной функции
ион-селективного электрода (3):
Е = Е0(Т) – S(T)pH.
При изменении температуры может
изменяться свободный член уравнения
(стандартный потенциал), т.к. он связан
с константой распределения иона водорода
между фазой мембраны и раствором.
Коэффициент наклона
S(T)
≈ 2,3RT/F
можно считать явной функцией температуры.
Настройку современного микропроцессорного рН-метра обычно осуществляют по двум стандартам при термостатировании. Параметры электродной функции хранятся в энергонезависимой памяти прибора. При измерениях испытуемых растворов, прибор вычисляет рНх = (Е0-Ех)/S. О термостатировании испытуемого раствора можно не заботиться, если осуществить температурную коррекцию параметров электродной функции.
Температурную коррекцию несложно осуществить, если использовать тот факт, что электродные функции стеклянного электрода при разных температурах пересекаются в одной точке (рНи, Еи), изопотенциальной точке, см. рис. 1. В математике эту точку называют центром пучка. Пучок прямых на рис. 2 описывается одним уравнением: Еx – Еи = S(T)(pHx – pHи). Координату (рНи, Еи) берут из паспорта фабричного электрода и заносят в память прибора при его градуировании или устанавливают экспериментально. Тогда измерив Еx и температуру испытуемого раствора можно по уравнению пучка рассчитать рНх. Микропроцессорный рН-метр выполнит эти вычисления автоматически, если к нему подключить электронный термометр (термометр сопротивления, датчик температуры, ДТ).
Потенциометрическое кислотно-основное титрование основано на установлении точки эквивалентности по изменению потенциала индикаторного электрода при проведении химической реакции между протолитом кислотой и протолитом основанием. Один из протолитов является определяемым веществом, а другой - титрантом.
Рис.3
Титрование 0,05 М HCl
0,05 M
NaOH
Приборы, оборудование и реактивы
pH-метр Эксперт-001 или его аналог.
Потенциометрическая пара электродов, составленная из индикаторного стеклянного рН-электрода и хлорсеребряного электрода сравнения (или комбинированный электрод).
Датчик температуры.
Мешалка магнитная.
Бюретка вместимостью 10 мл.
Стаканы химические низкие вместимостью 50 мл – 3 шт.
Стакан для титрования вместимостью 100 мл.
Пипетка мерная вместимостью 5 мл.
Емкости для отбора воды вместимостью 500 мл – 3 шт.
Промывалка.
Пинцет.
Стандарт–титры для приготовления образцовых буферных растворов для рН-метрии.
Стандартный раствор соляной кислоты 0,0500 М.
Стандартный раствор фосфорной кислоты 0, 025 М.
Раствор NaOH 0,05 M.
Фенолфталеин 1%-ный раствор в этиловом спирте.
ПРАКТИЧЕСКИЕ работы
Перед началом работы следует ознакомиться с руководствами по эксплуатации рН-метра1 и электродов, сделав необходимые выписки в лабораторном журнале. Включают анализатор, нажав кнопку «ВКЛ» На дисплее появится надпись:
Выбор режима
рН-метр-иономер
Нажимают кнопку «ИОН» и кнопками «◄» и «►» выбирают «рН». Нажав кнопку «ВВОД» входят в режим «рН-метр-иономер». Прогревают прибор в течение 20 мин и просматривают ранее внесенные в память прибора параметры прежней градуировки, согласно 2.3.1 ПРИЛОЖЕНИЯ.
Калибровка рН-метра по стандартным растворам рН. Определение рН водопроводной и дистиллированной воды
Порядок выполнения работы. Проверяют правильность прежней настройки прибора по буферному раствору с рН = 6,86. Наливают в стакан 20 мл буферного раствора, предварительно ополоснув его двумя последовательными порциями буфера по 5 мл. Снимают защитные колпачки с электродов и промывают их струей дистиллированной воды из промывалки. Осторожно осушают электроды и температурный датчик кусочком фильтровальной бумаги. Погружают потенциометрический и температурный датчики в раствор на глубину не менее 1,5 -2 см.
Входят режим измерений нажатием кнопки «ИЗМ», а затем кнопки «ТК». Результаты измерений будут выводиться на дисплее индикатора с учетом температурной компенсации. Записывают измеренные значения рН и температуры после установления, в течение не более 2 мин, их равновесных значений. Процедуру измерения повторяют два раза. Если разность параллельных результатов не выходит за пределы основной абсолютной погрешности, записанной в паспорте прибора: ±0,05 ед рН, то за измеренное значение принимают их среднее. В этом случае считают, что процесс измерения находится под статистическим контролем. В противном случае выясняют и устраняют причины погрешности и рН – метр калибруют по стандартным буферным раствора, согласно п.2.3.2 ПРИЛОЖЕНИЯ.
Контроль рН водных сред на примере водопроводной воды и дистиллированной воды. Отбирают пробы воды из холодного и горячего кранов в сухие бутыли. Воду заливают в бутыль по стенке тонкой струей до пробки так, чтобы не происходило перемешивание воды с воздухом лаборатории, а в бутылях не оставалось воздушных пузырей. Сосуды с пробами подписывают с указанием места и времени отбора проб. Выдерживают некоторое время при комнатных условиях, чтобы установилось температурное равновесие между водой и внешней средой. Приступают к измерениям рН.
Подготовку измерительных стаканов и датчиков проводят также как в предыдущих опытах. Вначале определяют рН дистиллированной воды в аналитической серии из 5 измерений. Каждое измерение осуществляют со свежей порцией 20 мл пробы. Аналогично исследуют «холодную» и «горячую» воду. Результаты определений рН заносят в табл. 2. Для каждой выборки вычисляют среднее и стандартное отклонение.
Из сравнения стандартных отклонений рН для отдельных проб делают вывод о воспроизводимости измерений рН в незабуференных растворах.
Таблица 2. Результаты определения рН в пробах воды
№ п/п |
Проба |
||
«дистиллят» |
«холодная» |
«горячая» |
|
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
4 |
|
|
|
5 |
|
|
|
Среднее |
|
|
|
Стандартное отклонение |
|
|
|
