
- •Курс лекций по дисциплине «Химия»
- •Омск- 2006 г. Оглавление
- •Периодическое изменение свойств атомов химических элементов
- •Общие представления о химической связи.
- •Характеристики химической связи.
- •Природа химической связи.
- •Типы связей.
- •Метод валентных связей
- •Понятие о методе молекулярных орбиталей
- •Первый закон термодинамики
- •Первое начало термодинамики
- •Энтальпия. Закон Гесса.
- •Тепловые эффекты химических реакций
- •Скорость химической реакции
- •Закон действующих масс.
- •Энергия активации химической реакции
- •Зависимость скорости реакции от катализатора
- •Фундаментальные постоянные
- •П.1. Наименование неорганических веществ
- •Общие понятия об электролизе.
- •Ионная теория электролиза.
- •Электролиз расплавов
- •Количественные законы электролиза.
- •Практическое значение электролиза.
Курс лекций по дисциплине «Химия»
кафедра «Физическая химия», ОмГТУ.
Омск- 2006 г. Оглавление
Лекция 1. Основные определения и количественные законы химии.
Стехиометрические расчёты...……………………………………………………….3
Лекция 2. Строение атома……………………………………………………………………....14
Лекция 3. Химическая связь…………………………………………………………………….27
Лекция 4. Классификация и номенклатура неорганических соединений……………………45
Лекция 5. Химическая термодинамика………………………………………………………...49
Лекция 6. Химическая кинетика………………………………………………………………...58
Лекция 7. Химическое равновесие……………………………………………………………...64
Лекция 8. Растворы………………………………………………………………………………67
Лекция 9. Растворы электролитов………………………………………………………………74
Лекция 10. Окислительно-восстановительные реакции……………………………………….81
Лекция 11. Химические свойства металлов…………………………………………………….92
Лекция 12. Гетерогенные окислительно-восстановительные реакции……………………….96
Лекция 13. Химические источники тока……………………………………………………….101
Лекция 14. Электролиз…………………………………………………………………………..108
Лекция 15. Коррозия металлов………………………………………………………………….113
Лекция 16. Защита металлов от коррозии………………………………………………………119
Лекция 17. Конструкционные и электротехнические материалы……………………………..125
Лекция 1. Основные определения и количественные законы химии. Стехиометрические расчёты.
Основные определения химии: химический элемент, атом, молекула, химические символы. Количественные законы химии: закон сохранения массы, закон сохранения энергии, закон эквивалентов и кратных отношений. Количество вещества, моль, молярная масса, относительная атомная масса и молекулярная массы, постоянная Авогадро. Понятие химической реакции. Изменение состава химических соединений в ходе химических реакций. Вычисления с помощью стехиометрических уравнений.
Основные определения химии
Молекула – наименьшая частица индивидуального вещества, способная к самостоятельному существованию и обладающая его основными свойствами. Она состоит из атомов – структурных единиц вещества, которые нельзя разделить на составные части химическим путем.
Атом представляет собой электронейтральную частицу, состоящую из положительно заряженного ядра и движущихся вокруг него отрицательно заряженных электронов. Каждый атом имеет свой заряд ядра. Совокупность одинаковых атомов, имеющих один и тот же заряд ядра, называют химическим элементом. Каждый химический элемент имеет свой символ и порядковый номер, соответствующий заряду его ядра. Каждый химический элемент занимает своё место в Периодической системе химических элементов Д.И. Менделеева. В свободном состоянии химические элементы находятся в виде простых веществ.
Простыми называют вещества, состоящие из атомов одного элемента. Их обозначают химической формулой Аn, где А – символ химического элемента, n – число атомов в молекуле. Среди простых веществ выделяют металлы и неметаллы. К металлам относят простые вещества такие как литий (Li), бериллий (Be), натрий (Na), магний (Mg), калий (K), кальций (Ca), медь (Cu), цинк (Zn), рубидий (Rb), стронций (Sr), серебро (Ag), кадмий (Cd), цезий (Cs), барий (Ba), золото (Au), ртуть (Hg), франций (Fr), радий (Ra). К неметаллам относятся простые вещества такие как водород (Н), бор (В), углерод (С), кремний (Si), азот (N), фосфор (Р), мышьяк (Аs), кислород (О), сера (S), селен (Se), теллур (Те), фтор (F), хлор (Сl), бром (Br), йод (I), астат (Аt), гелий (Не), неон (Ne), аргон (Аr), криптон (Кr), ксенон (Хе), радон (Rn).
Химические элементы могут существовать в виде нескольких простых веществ, различающихся по количественному составу или кристаллическому строению. Например, кислород существует в виде дикислорода О2 (обычно называемого кислородом) и трикислорода О3 (называемого озоном), а углерод встречается в виде графита α-С, алмаза β-С, карбина (С2)n, фуллеренов С60, С70. Различные виды одного и того же элемента называются аллотропными модификациями.
Сложные вещества представляют собой химические соединения элементов простых веществ. Поэтому они состоят из атомов двух или более элементов. Для сложных веществ записывают химические формулы с помощью символов элементов и числовых индексов. Химические символы отражают качественный, а числовые индексы количественный состав соединения. Например, Н2О – формула воды, молекулы которой состоят из двух атомов водорода и одного атома кислорода.
Имеются различные способы составления химической формулы сложного вещества. Эмпирическая формула, записывается на основании расчёта известного из эксперимента массового отношения элементов в соединении. Такая формула отражает количественный состав молекулы. Например, для этилового спирта она может быть записана как С2Н6О. Однако такая же эмпирическая формула может принадлежать и другому веществу, например С2Н6О соответствует диметиловому эфиру. Поэтому на основании дополнительных сведений эмпирические формулы уточняют и записывают формулу соединения с учётом его молекулярной структуры, которая называется молекулярной формулой. Для этилового спирта молекулярная формула записывается как С2Н5ОН, а для диметилового эфира – СН3ОСН3. Для того чтобы показать взаимное расположение атомов в молекуле, часто используют графические формулы, в которых черточкой обозначают связь между атомами:

этиловый спирт диметиловый эфир
Международным союзом теоретической и прикладной химии разработана химическая номенклатура ИЮПАК (IUPAC), которая представляет собой правила составления химических формул и способы наименования индивидуальных химических веществ. Применение данных правил рассматривается ниже (Лекция №4).
Основные количественные законы химии
Теоретической базой количественных расчетов химических реакций являются стехиометрические законы: Закон сохранения массы, Закон кратных отношений, Закон объемных отношений, Закон эквивалентов, Закон Авогадро, Закон Бройля-Мариотта, Закон Гей-Люссака, закон Дальтона.
В стехиометрии используют следующие понятия.
Формульная
единица вещества
– реально существующие частицы: атомы
(S,
C,
Fe),
молекулы (Н2О,
СО2),
ионы (Са2+,
![]() ),
радикалы (ОН, NO2)
и другие частицы вещества.
),
радикалы (ОН, NO2)
и другие частицы вещества.
Моль
– количество вещества, содержащее
столько формульных единиц, сколько
атомов содержится в 0,012 кг изотопа
углерода
![]()
Постоянная Авогадро NA – число частиц в 1 моль любого вещества; NA ≈ 6,022∙1023 моль-1.
Молярная масса М – масса 1 моль вещества. Молярная масса численно совпадает с массами атомов и молекул, выраженных в атомных единицах массы, и измеряется в граммах на моль (г/моль).
Молярный объем VМ – объем 1 моль газа, измеряется в литрах на моль (л/моль).
Химический эквивалент Э – реальная или условная частица, которая может присоединять, высвобождать или быть каким-либо другим способом равноценна одному атому (иону) водорода в обменных (кислотно-основных) реакциях или одному электрону в окислительно-восстановительных реакциях.
Число эквивалентности (эквивалентное число) zэкв показывает, сколько химических эквивалентов содержит одна формульная единица вещества.
Фактор эквивалентности fэкв – величина, обратная числу эквивалентности; показывает, какая доля формульной единицы вещества приходится на один химический эквивалент
fэкв= 1/ zэкв (1).
Молярная масса химического эквивалента Мэкв вещества – масса 1 моль химического эквивалента вещества; выражается в граммах на моль (по правилам ИЮПАК указание на эквивалент при записи размерности Мэкв опускается) и связана с молярной массой вещества соотношением:
![]() (2).
(2).
Молярный объем химического эквивалента Vэкв вещества – объем 1 моль химического эквивалента газа; выражается в литрах на моль и связан с молярным объемом соотношением:
![]() (3).
(3).
Закон сохранения массы (М.В. Ломоносов, 1756; А. Лавуазье, 1777). Общая масса веществ, вступивших в химическую реакцию, равна общей массе продуктов реакции.
Закон постоянства состава (Ж. Пруст, 1797). Всякое чистое вещество независимо от способа его получения, имеет постоянный качественный и количественный состав.
Закон кратных отношений (Дж. Дальтон,1803). Если два элемента образуют между собой несколько молекулярных соединений, то массовые количества одного элемента, приходящиеся на одно и то же массовое количество другого, соотносятся между собой как небольшие целые числа.
Закон объемных отношений (Ж. Гей-Люссак,1808). Объемы вступающих в химическую реакцию газов и газообразных продуктов реакции относятся друг к другу как небольшие целые числа.
Закон эквивалентов (И. Рихтер, 1792). Химические элементы входят в состав соединений в строго определенных отношениях масс, поэтому вещества реагируют и образуются в эквивалентных количествах.
При расчетах реакций, протекающих с участием газообразных веществ, опираются на основные газовые законы. Газовые законы – это математические соотношения между температурой, давлением и объёмом.
Закон Авогадро В 1811 г. Авогадро выдвинул гипотезу, согласно которой равные объёмы всех газов при одинаковых температуре и давлении содержат одинаковое число молекул. В дальнейшем данная гипотеза получила название закона Авогадро, который формулируется как:
В равных объемах идеальных газов, при одинаковых давлении и температуре содержится одинаковое число молекул.
Число молекул в одном моле любого газа равно 6,022 ∙1023. Это число называется постоянной Авогадро и обозначается через NА. Оно имеет размерность моль-1. Постоянная Авогадро – это число любых частиц – атомов, молекул, ионов, электронов в одном моле.
Согласно этому закону, 1 моль идеального газа при нормальных условиях (н.у.), Т0=273,15 К; р0=101,3 кПа, занимает объем VМ=22,414 л/моль или 22,414 дм3/моль. Эта величина называется молярный объём.
Поскольку 1 моль любого газа при нормальных условиях занимает объём 22,4 дм3, то отсюда можно вычислить плотность газа. Например, 1 моль газообразного СО2 (44 г/моль) занимает объём 22,4 дм3, поэтому плотность газа СО2 при нормальных условиях равна
ρ(СО2)
=
![]() = 1,96 г/дм3.
= 1,96 г/дм3.
При таком расчете мы предполагали, что СО2 подчиняется закону Авогадро, и подчиняется уравнению состояния идеального газа.
Закон Бройля-Мариотта (Р. Бойль,1662; Э. Мариотт,1667). При постоянной температуре объем данного количества газа обратно пропорционален давлению, под которым он находится:
V
![]() (4),
(4),
где V – объём, р – давление.
Таким образом, объём газа уменьшается при увеличении давления.
В современной записи закон Бойля-Мариотта имеет вид
![]() (5).
(5).
Это выражение позволяет, например, зная исходный объём газа V1 и его давление р1, вычислить давление р2 в новом объёме V2.
Закон Гей-Люссака (закон Шарля). В 1787 г. Шарль показал, что при постоянном давлении объём газа изменяется пропорционально его температуре. В математической форме эта зависимость выражается следующим образом
V
![]() (6),
(6),
где Т – абсолютная температура.
Закон Шарля усовершенствовал Ж. Гей-Люссак в 1802 г., который установил, что объём газа при изменении его температуры на 1 0С изменяется на 1/273 часть того объёма, который он занимал при 0 0С. Современная формулировка закона и его математическая запись следующая:
При постоянном давлении изменение объема газа прямо пропорционально температуре:
![]() (7).
(7).
Объединенный газовый закон. Последние два газовых закона обычно объединяют вместе в виде формулы объединенного газового закона:
![]() (8),
(8),
где p, V и Т – давление, объем и температура данного количества газа в состояниях 1и 2 соответственно. Данный закон позволяет вычислить, например, объём газа при определенных температуре и давлении, если известен его объём при других значениях температуры и давления.
Объединенный газовый закон можно записать в виде выражения
![]() =
const.
=
const.
Значение константы зависит от количества газа. Для 1 моль газа const = 8,314
Дж∙К-1∙моль-1. Данное значение обозначается через R, так как оно является постоянным и называется универсальной газовой постоянной. Используя данное обозначение, объединенный газовый закон для 1 моль газа записывают в виде
pVm = RT (9),
где Vm – объём 1 моль газа.
Если количество газа отлично от 1 моль, то уравнение принимает вид
![]() (10),
(10),
где n – число молей данного газа. Записанное в таком виде выражение называется уравнением Клапейрона-Менделеева, а также уравнением состояния идеального газа.
Число молей газа n может быть определено как отношению массы m данного вещества к его молярной массе M, то есть в виде
![]() (11).
(11).
Уравнение состояния – это уравнение, связывающее между собой параметры состояния: давление, объём, температуру. Газ, полностью подчиняющийся уравнению состояния идеального газа, называется идеальным газом. Реальные газы подчиняются уравнению идеального газа только при низких давлениях и высоких температурах.
Закон парциальных давлений или закон Дальтона (Дж. Дальтон,1801). Формулировка закона следующая.
Общее давление смеси газов, химически не взаимодействующих между собой, равно сумме их парциальных давлений:
![]() (12).
(12).
Парциальное давление pi – давление i-го газа, входящего в состав смеси, которое создавал бы этот газ, если бы он один при той же температуре занимал объем, равный объему всей смеси.
На основе стехиометрических и газовых законов, по известному количеству одного из веществ, рассчитывают значения масс и объемов остальных участников реакции.
Наиболее часто при количественных расчетах используют закон эквивалентов, который позволяет во многих случаях обойтись без составления уравнения химической реакции. Закон эквивалентов формулируется следующим образом:
один химический эквивалент одного вещества всегда взаимодействует с одним химическим эквивалентом другого.
Поэтому для условной реакции
![]()
где A, B, D, F – участники реакции; νА, νВ, νD, νF – соответствующие стехиометрические коэффициенты, числа молей химических эквивалентов nэкв участников реакции одинаковы:
![]()
![]()
Для расчета массовых отношений участников химической реакции удобно использовать другую формулировку закона эквивалентов:
массы реагирующих между собой веществ, а также массы продуктов реакции пропорциональны молярным массам химических эквивалентов этих веществ.
![]() (13).
(13).
Если реакция протекает в газовой фазе, то можно использовать соответствующие объемные соотношения:
![]() (14).
(14).
Отметим, что когда А – твердое вещество, а В – газ, справедливо выражение
![]() (15).
(15).
В стехиометрических расчетах, основанных на законе эквивалентов, главным является установление чисел эквивалентности zэкв участников реакции. В обменных реакциях число эквивалентности вещества определяется стехиометрическим уравнением реакции. Если известно число эквивалентности zэкв А вещества А в реакции
то число эквивалентности zэкв В вещества В можно найти из соотношения:
![]()
.
Стехиометрические законы справедливы только для соединений с молекулярной структурой, химический состав которых постоянен и не зависит от способа их получения. Данные соединения называются дальтониды. Соединения с немолекулярной структурой имеют переменный состав, зависящий от способа их получения. Такие соединения называются бертоллиды. Примерами последних веществ являются соединения металлов между собой (интерметаллиды), а также многочисленные оксиды, сульфиды, селениды, теллуриды, нитриды, карбиды, фосфиды, силициды. Для таких соединений законы постоянства состава, кратных отношений и эквивалентов применять нельзя.
Формульная единица вещества – реально существующие частицы: атомы (S, C, Fe), молекулы (Н2О, СО2), ионы (Са2+, ), радикалы (ОН, NO2) и другие частицы вещества.
Моль – количество вещества, содержащее столько формульных единиц, сколько атомов содержится в 0,012 кг изотопа углерода
Постоянная Авогадро NA – число частиц в 1 моль любого вещества; NA ≈ 6,022∙1023 моль-1.
Молярная масса М – масса 1 моль вещества. Молярная масса численно совпадает с массами атомов и молекул, выраженных в атомных единицах массы, и измеряется в граммах на моль (г/моль).
Молярный объем VМ – объем 1 моль газа, измеряется в литрах на моль (л/моль).
Химический эквивалент Э – реальная или условная частица, которая может присоединять, высвобождать или быть каким-либо другим способом равноценна одному атому (иону) водорода в обменных (кислотно-основных) реакциях или одному электрону в окислительно-восстановительных реакциях.
Число эквивалентности (эквивалентное число) zэкв показывает, сколько химических эквивалентов содержит одна формульная единица вещества.
Фактор эквивалентности fэкв – величина, обратная числу эквивалентности; показывает, какая доля формульной единицы вещества приходится на один химический эквивалент fэкв= 1/ zэкв.
Молярная масса химического эквивалента Мэкв вещества – масса 1 моль химического эквивалента вещества; выражается в граммах на моль (по правилам ИЮПАК указание на эквивалент при записи размерности Мэкв опускается) и связана с молярной массой вещества соотношением:
(1).
Молярный объем химического эквивалента Vэкв вещества – объем 1 моль химического эквивалента газа; выражается в литрах на моль и связан с молярным объемом соотношением:
(2).
Масса и количество вещества - разные понятия. Масса выражается в килограммах или граммах, а количество вещества в молях. В химии в связи с использованием химических уравнений расчёт или интерпретацию количественного результата обычно производят в молях. Но от молей всегда можно перейти к массе. Между массой вещества и количеством вещества справедливы следующие соотношения:
(3)
![]() (4)
(4)
m = M∙n (5),
где n – количество вещества в молях; m – масса вещества в г; М – молярная масса в г/моль.
Химические формулы и знаки позволяют записывать химические реакции и отражают закон сохранения массы вещества. Под химической реакцией понимают процессы взаимодействия веществ, приводящие к образованию новых соединений. Вещества, которые подвергаются превращению с изменением химического состава, называют исходными реагентами. Образующиеся в ходе реакции вещества называются продуктами реакции. Запись символов элементов и формул соединений исходных реагентов и продуктов реакции в виде алгебраического уравнения называется уравнением химической реакции или уравнением реакции. Химическое уравнение, в котором указано относительное количество реагентов и продуктов реакции, называют стехиометрическим. Например, взаимодействие кальция с водой приводит к образованию гидроксида кальция и выделению водорода. Эту реакцию записывают в виде химического уравнения:
![]()
или стехиометрического уравнения, включающего стехиометрические коэффициенты, которые отражают относительное количество участников реакции:
![]() .
.
В некоторых случаях в химических уравнениях указывают буквенными индексами физические состояния реагентов и продуктов реакции, а именно: к – кристаллическое, т – твердое, ж – жидкое, г – газообразное, р – растворенное. Выпадение осадков и выделение газов указывается вертикальными стрелками соответственно ↓ и ↑ например:
![]() ↑.
↑.
Число атомов каждого элемента в левой и в правой частях уравнения должно быть одинаковым.
Для примера составим уравнение реакции взаимодействия хлорида железа (III) с гидроксидом натрия
FeCl3 + NaOH → Fe(OH)3 + NaCl.
Для того, чтобы уравнять число атомов железа, натрия, хлора, кислорода и водорода в левой и в правой частях уравнения, надо перед формулами NaCl и NaOH поставить коэффициент 3, то есть записать
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl .
В полученном уравнении число атомов каждого элемента в левой части равно числу тех же атомов правой. Это означает, что данное уравнение удовлетворяет закону сохранения массы вещества.
Вещества, взаимодействуя друг с другом, подвергаются различным изменениям и превращениям. Явления, при которых одни вещества превращаются в другие, отличающиеся от исходных составом и свойствами, и при этом не происходит изменение состава ядер, называются химическими. Окисление на воздухе, горение, получение металлов из руд – все это примеры химических явлений, которые также называются химическими превращениями, химическими реакциями, химическими взаимодействиями. Таким образом, химические реакции могут, происходит с изменением числа исходных и конечных веществ реакции. Примерами таких реакций являются реакции соединения, разложения, замещения, обмена.
Реакциями соединения называются реакции, в результате которых из двух или нескольких веществ образуется одно новое вещество, например
HCl + NH3 = NH4Cl.
Реакциями разложения называются реакции, в результате которых из одного вещества образуется несколько новых веществ, например
2HI = H2 + I2.
Реакции между простыми и сложными веществами, в результате которых атомы простого вещества замещают атомы одного из элементов сложного вещества, называются реакциями замещения, например
реакция вытеснения брома хлором:
2NaBr + Cl2 = Br2 + 2NaCl.
Реакции, в результате которых два вещества обмениваются своими составными частями, образуя два новых вещества, называются реакциями обмена, например
Ca(OH)2 + 2HCl = CaCl2 + 2H2O.
Коэффициенты перед формулами веществ в уравнениях реакций могут выражать не только число атомов, а и количество вещества в молях. Поэтому коэффициенты перед формулами веществ в уравнениях реакции называют стехиометрическими. Стехиометрические количества – это количества веществ, которые соответствуют уравнению реакции или формуле. Нахождение этих коэффициентов осуществляется с помощью стехиометрических расчётов.
Так как между количеством вещества, его массой и числом атомов имеется прямая связь, то обычно в уравнении химической реакции каждая формула изображает один моль вещества. Поэтому, зная мольные массы участвующих в реакции веществ, можно по уравнению реакции найти соотношение между массами веществ, вступающих в реакцию и образующихся в результате её протекания. Если в реакции участвуют газы, то уравнение реакции позволяет найти их объёмные отношения.
Пример 1. Найти массу серной кислоты, необходимую для полной нейтрализации 20 г гидроксида натрия
Решение:
Уравнение реакции имеет вид
H2SO4 + 2NaOH = Na2SO4 + 2H2O.
Молекулярные массы H2SO4 и NaOH соответственно равны 98 и 40, следовательно их молекулярные массы составляют 98 и 40 г/моль. Согласно уравнению реакции 1 моль H2SO4 реагирует с 2 молями NaOH. Таким образом,
98 г H2SO4 нейтрализует 80 г NaOH,
х г H2SO4 нейтрализует 20 г NaOH.
Отсюда находим х = (98∙20)/80 = 24,5 г.
Стехиометрические расчеты по химическим уравнениям
Пример: определите массу иода, которая потребуется для получения иодида
алюминия массой 61,2 г.
Решение:
Записываем уравнение реакции
2Al + 3I2 = 2Al I3.
Рассчитаем количество вещества иодида алюминия, которое требуется получить
n (Al I3) = m(Al I3)/M(Al I3) = 61,2/408 = 0,15 моль.
Из уравнения реакции следует: для получения 2 моль Al I3 требуется 3 моль I2.
Поэтому n(Al I3)/n(I2) = 2/3.
Отсюда получаем
n(I2)
=
![]() n(Al I3)
=
∙ 0,15 = 0,225 моль.
n(Al I3)
=
∙ 0,15 = 0,225 моль.
Рассчитаем массу иода, которая требуется для осуществления процесса
m(I2) = n(I2)∙M(I2) = 0,225∙254 = 57,15 г.
Пример:
Сплав из элементов натрия и калия массой 13,1 г поместили в воду, в результате чего образовался раствор. Для нейтрализации полученного раствора к нему прилили 25% -ный водный раствор азотной кислоты плотностью 1,15 г/см3 в количестве 109,6 мл. Чему равна массовая доля натрия в сплаве?
Решение:
Введём обозначения:
m Na + K – масса сплава Na и K; mK – масса калия; mNa – масса натрия; V(HNO3) – объём водного раствора азотной кислоты;
C% (HNO3) – процентная концентрация водного раствора азотной кислоты; ρ(HNO3) – плотность водного раствора азотной кислоты; ωК – массовая доля калия в сплаве; ωNa – массовая доля натрия в сплаве.
По условию задачи имеем
m Na + K = 13,1 г
V(HNO3) = 109,6 мл
C% (HNO3) = 25 %
Необходимо найти ωNa - ?
Составим уравнения химических реакций, протекающих при погружении в воду сплава из натрия и калия.
2Na + 2H2O = 2NaOH + H2↑ (6)
2K + 2H2O = 2KOH + H2↑ (7)
При погружении в воду сплава из натрия и калия образуются основания NaOH и KOH. Пусть масса Na в сплаве – x, а масса NaOH – y1.
Х = ?
Для нахождения х составим на него уравнение.
Взаимодействие NaOH и KOH с азотной кислотой происходит в соответствии с уравнениями
NaOH + HNO3 = NaNO3 + H2O (8)
KOH + HNO3 = 2KOH + H2O (9).
Пусть масса водного раствора HNO3 пошедшего на нейтрализацию NaOH равна у3, а масса водного раствора HNO3, пошедшего на нейтрализацию KOH равна у4. Молярная масса двух молей Na равна 46 г, а двух молей NaOH – 80 г.
Согласно уравнению (6) составляем пропорцию
46 – 80
х – у1
Отсюда получаем,
что у1
=
![]() .
.
Молярная масса двух молей К равна 78 г, а двух молей КОН – 112 г. Согласно уравнения (7) составляем пропорцию
78 – 112
(13,1–х) - у2.
Отсюда получаем,
что у2
=
![]() .
.
Согласно уравнения (8) составляем пропорцию
40 г/моль - 63 г/моль
у1 - у3.
Отсюда получаем,
что у3
=
![]() =
=
![]() .
.
Согласно уравнения (4) составляем пропорцию
56 г/моль KOH - 63 г/моль HNO3
у 2 - у4.
Отсюда получаем,
что у4
=
![]() =
=
![]() .
.
Mк-ты = у3 + у4 (10).
mр-ра = V(HNO3) ∙ ρ(HNO3) = 109,6 ∙ 1,15 = 126,04 г
Массу кислоты в растворе mк-ты можно найти из пропорции
х - 25%
126,04 - 100%
Отсюда находим mк-ты = х = (126,04 ∙ 25)/100 = 31,05 г.
Из выражения (10) составляем уравнение для определения х, которое имеет следующий вид
+ = 31,51.
Решая данное уравнение получаем х = 9,2 г, то есть mNa = 9,2 г, массу калия в сплаве находим как mK = 13,1 – 9,2 = 3,9 г.
Из пропорции 13,1 - 100%
9,2 - х%
Находим х = 9,2∙ 100/13,1 = 70,2 %. Таким образом, ωNa = 70,2%.
Ответ: массовая доля натрия в сплаве равна ωNa = 70,2%.
Лекция 2. Строение атома.
Строение атома. Квантово-механическая модель атома. Квантовые числа. Атомные орбитали. Принцип Паули. Правила и порядок заполнения атомных орбиталей.
Строение атома. Квантово-механическая модель атома.
До конца 19 века атом считался неделимым. Затем по мере накопления опытных данных пришлось отказаться от таких взглядов и признать, что атомы имеют сложное строение.
Для объяснения
опытных данных по рассеянию
![]() -
частиц Э. Резерфорд предложил ядерную
модель атома. Согласно этой модели атом
состоит из массивного положительно
заряженного ядра, при этом очень малого
по размерам. В ядре сосредоточена почти
вся масса атома. Вокруг ядра на значительном
расстоянии от него вращаются электроны,
образующие электронную оболочку атома.
-
частиц Э. Резерфорд предложил ядерную
модель атома. Согласно этой модели атом
состоит из массивного положительно
заряженного ядра, при этом очень малого
по размерам. В ядре сосредоточена почти
вся масса атома. Вокруг ядра на значительном
расстоянии от него вращаются электроны,
образующие электронную оболочку атома.
Размер всего атома составляет около 10-8 см, ядра – порядка 10-13 см. По размеру ядро примерно в 100000 раз меньше атома.
Поскольку атом в целом электронейтрален, то суммарный заряд электронов должен быть равен заряду ядра. Дальнейшие исследования показали, что положительный заряд ядра атома численно равен порядковому номеру элемента в периодической системе Д.И. Менделеева.
Таким образом, число положительных зарядов ядра каждого атома, а также число вращающихся в поле ядра электронов равны порядковому номеру элемента.
Порядковый номер атома титана равен 22. Значит, его положительный заряд равен 22 и в поле ядра вращаются 22 электрона.
При химических реакциях ядро атома не претерпевает изменений. Изменению подвергаются электронные оболочки атомов, строением которых объясняются многие свойства химических элементов. Поэтому состояние электронов в атоме определяет многие свойства.
Электрон – это очень маленькая частица, для которой законы классической механики не выполняются. Такая частица не имеет траектории, обладает волновыми свойствами. Для её характеристики требуется привлечение других понятий. Состояние электронов в атоме описывается квантовой механикой.
Квантовая механика базируется на трех основных положениях:
энергетические изменения, происходящие в микросистемах, носят дискретный характер (принцип квантования энергии);
поведение микрочастиц (в том числе и электронов) определяется двойственностью их природы (корпускулярно-волновой дуализм);
законы микромира обусловлены статистическим (вероятностным) характером.
Квантование энергии. Для объяснения способностей излучения нагретых тел М. Планк в 1900 г. выдвинул предположение, что энергия излучается и поглощается не непрерывно, а дискретно отдельными порциями – квантами. Энергия Е кванта зависит от частоты электромагнитного излучения ν:
Е=hν (1),
где h – постоянная Планка; ν=с/λ (λ – длина волны излучения); с – скорость света. Идея о квантовании энергии позволила объяснить фотоэлектрический эффект (А.Эйнштейн,1905) и линейчатую структуру атомных спектров (Н. Бор,1913).
Корпускулярно-волновой дуализм характеризует способность любого объекта проявлять одновременно волновые и материальные свойства. Двойственная природа микромира была впервые установлена для излучения. С одной стороны, для излучения характерны такие явления, как интерференция и дифракция, которые характеризуют его волновую природу. С другой стороны, излучение проявляет свойства частиц, о чем свидетельствует явление фотоэффекта. Эйнштейн предположил, что излучение испускается в виде частиц, называемых фотонами или квантами. Каждый фотон обладает энергией, определяемой (1).
В силу корпускулярной природы излучения фотоны должны обладать определенной массой. Масса покоя фотона равна нулю, а при движении фотон приобретает динамическую массу. Для вычисления этой массы Эйнштейн обосновал применение уравнение эквивалентности массы и энергии:
Е=mc2.
В то же время Е=hν=h(с/λ). Отсюда следует
![]() (2).
(2).
Здесь рф=mc – импульс фотона. Французский физик Л. де Бройль в 1923 г. предположил, что двойственной природой обладает не только свет, но и любой материальный объект (в частности, электрон). Длина волны любого движущегося объекта
![]() (3),
(3),
где m
– масса частицы;
![]() - скорость движения частицы; λ
– длина волны объекта, называемая длиной
волны де Бройля.
Из этого выражения следует, что чем
меньше масса частицы, тем больше длина
ее волны и тем значительней проявляются
ее волновые свойства.
- скорость движения частицы; λ
– длина волны объекта, называемая длиной
волны де Бройля.
Из этого выражения следует, что чем
меньше масса частицы, тем больше длина
ее волны и тем значительней проявляются
ее волновые свойства.
Уравнение де Бройля (3) в 1927 г. было подтверждено экспериментально. Американские физики Дж. Дэвиссон и А. Джермер обнаружили дифракцию электронов на монокристаллах никеля Ni. Позднее способность к дифракции была обнаружена у других микрообъемов (атомов гелия Не, молекул водорода Н2, нейтронов).
В макромире волновые свойства не проявляются – перемещение тел хорошо описывается как движение частиц. Причина заключается в том, что постоянная Планка очень мала, поэтому длины волн оказываются соизмеримыми с размерами частиц только в микромире.
Принцип неопределенности. Волновые свойства микрочастиц выражаются также в ограниченности применения к ним некоторых понятий классической механики, а именно координаты и импульса. Например, один из способов наблюдения за объектом – воздействие на него электромагнитного излучения (свет, радиоволны) и регистрация отраженного сигнала, что широко используется в радиолокации, эхолокации. Причем чем сильнее воздействие на наблюдаемый объект, тем сильнее отраженный сигнал. Если ведется наблюдение за микрообъектами, то действие на них электромагнитного излучения не изменяет ни их положения, ни их скорости. В случае наблюдения за объектами микромира (например, электронами) ситуация выглядит иначе. При действии кванта света (фотона) на микрочастицу ее скорость не остается без изменения. Зная положение микрочастицы в какой-то момент времени, нельзя в это же мгновение определить ее скорость, поскольку она уже изменилась.
В. Гейзенберг в 1927 г. предложил соотношения, которые получили название принципа неопределенности. Согласно этому принципу, невозможно одновременно точно определить координаты частица и ее импульс.
Математически принцип неопределенности формулируется следующим образом:
![]()
где Δx, Δy, Δz – погрешность определения координат x, y, z соответственно; Δpx, Δpy, Δpz – погрешность определения проекций импульса на оси координат. Из этих соотношений следует, что чем точнее определены координаты электрона, тем с меньшей точностью будет найден его импульс, и наоборот. Другими словами, говорить о траектории движения электрона не имеет смысла, так как для ее описания необходимо точно знать координаты электрона и его импульс в каждый момент времени. Из соотношений неопределенности следует, что точно описать движение такой микрочастицы, как электрон невозможно. Движение электрона можно описать, используя вероятностный подход, причем есть лишь определенная вероятность нахождения электрона в заданной области пространства.
Движущейся частице можно поставить в соответствие волновой процесс с длиной волны (3), тогда этот процесс будет характеризоваться частотой ν и волновой функцией Ψ – величиной, определяющей волнообразно распространяющееся возмущение.
![]()
Здесь ψ(x, y, z) – амплитуда волн де Бройля или координатная волновая функция, зависящая только от пространственных координат.
Стационарное уравнение Шрёдингера.
Законы движения частиц в квантовой механике выражаются уравнением Шрёдингера, которое играет ту же роль, что и законы Ньютона в классической механике. Уравнение Шрёдингера представляет собой дифференциальное уравнение в частных производных. Э. Шрёдингер в 1926 г. предложил использовать волновое уравнение в качестве модели для описания поведения электрона в атоме – уравнение, связывающее энергию системы с ее волновым движением. Стационарное уравнение Шрёдингера для одной части можно записать в следующей форме:
![]() (4)
(4)
где U – потенциальная энергия частицы; Е – ее полная энергия; x, y, z – декартовы координаты. Входящую в (4) переменную величину называют ψ волновой функцией. Эта функция описывает все свойства системы в стационарном состоянии – состоянии, которое не изменяется во времени. Функция ψ зависит от координат частиц и может зависеть от времени. Квадрат ее абсолютной величины |ψ|2 характеризует вероятность нахождения частицы в данном месте пространства. Величина |ψ|2dV равна вероятности нахождения рассматриваемой частицы в элементе объема dV=dxdydz.
Уравнение Шрёдингера часто записывают в следующей форме:
![]() (5)
(5)
где
![]() -
оператор Гамильтона:
-
оператор Гамильтона:
![]() (6)
(6)
Квантово-механическое решение задач в теории атома и молекулы сводится к нахождению удовлетворяющих уравнению Шрёдингера волновых функций и значений энергии. Вообще говоря, может быть несколько различных функций ψ1, ψ2, ψ3, …, ψn, которые являются решениями уравнения Шрёдингера, причем каждой соответствует свое значение энергии E1, E2, …, En.
Волновые функции, для которых уравнение Шрёдингера имеет решение, называют собственными функциями; значения энергии, вычисленные из таких решений – собственными значениями.
Таким образом, согласно представлениям квантовой механики, вероятность пребывания электрона в различных областях пространства неодинакова. Современным представлениям отвечает понятие об электронном облаке, плотность которого в различных точках определяется |ψ|2. В научной литературе используют понятие «орбиталь», которое характеризует совокупность положений электрона в атоме. Каждой орбитали соответствует определенная волновая функция.
Уравнение (6) в сферических координатах приобретает вид
![]()
Решая это уравнение, получают
![]() (7)
(7)
где R(r) – радикальная составляющая волновой функции; Θ(θ) и Φ(φ) – угловые составляющие волновой функции. Следовательно, волновые функции в (7) зависят от трех целочисленных параметров n, l и m, которые называют квантовыми числами.
Квантовые числа. Атомные орбитали.
Волновую функцию (7), описывающую состояние электрона, называют атомной орбиталью (АО).
Квантовые числа. В квантовой механике каждая АО определяется тремя квантовыми числами.
Главное квантовое число n. Может принимать целочисленные значения от 1 до ∞. Главное квантовое число определяет:
номер энергетического уровня;
интервал энергий электронов, находящихся на данном уровне;
размеры орбиталей;
число подуровней данного энергетического уровня (первый уровень состоит из одного подуровня, второй – из двух, третий – из трех и т.д.);
В Периодической системе элементов максимальному значению главного квантового числа соответствует номер периода.
Орбитальное квантовое число l. Определяет орбитальный момент количества движения (импульс) электрона, точное значение его энергии и форму орбиталей. Может принимать значения 0, 1, 2, 3, …, (n-1).
Атомная орбиталь – геометрический образ одноэлектронной волновой функции ψ, представляющий собой область наиболее вероятного пребывания электрона в атоме. Она ограничивает область пространства, в которой вероятность нахождения электрона имеет определенное значение (90 …99 %). Иногда орбиталью называют граничную поверхность этой области, а на рисунках, как правило, изображают сечение этой области плоскостью, проходящей через начало координат и лежащей в плоскости рисунка. В начало координат помещают центр ядра атома. Понятие «орбиталь», в отличие от «орбита», не подразумевает знания точных координат электрона. Орбитальное квантовое число определяет форму атомной орбитали. При l =0 это сфера, при l =1 – объемная восьмерка (гантель), при l=2 – четырехлепестковая розетка.
Каждому значению главного квантового числа соответствует n значений орбитального квантового числа l (табл. 1). Например, если n=1, то l принимает только одно значение (l =0), n =2 – два значения: 0 и 1 и т.д. Каждому численному значению l соответствует определенная геометрическая форма орбиталей и приписывается буквенное обозначение. Первые четыре буквы обозначения имеют историческое происхождение и связаны с характером спектральных линий. s, p, d, f – первые буквы английских слов, использованных для названия спектральных линий: sharp (резкий), principal (главный), diffuse (диффузный), fundamental (основной). Обозначения других орбиталей приведены в алфавитном порядке: g, h, …
Таблица 1
Значения главного и орбитального квантовых чисел
Орбитальное квантовое число l |
Главное квантовое число n |
||||||||||||||
1 |
2 |
3 |
4 |
5 |
|||||||||||
Значение Буквенное обозначение |
0
s |
0
s |
1
p |
0
s |
1
p |
2
d |
0
s |
1
p |
2
d |
3
f |
0
s |
1
p |
2
d |
3
f |
4
g |
Обозначение любого
подуровня определяется двумя квантовыми
числами – главным (при записи указывается
численное значение) и орбитальным (при
записи указывается буквенное
обозначениеорбитальным
()ается численное значение двумя
квантовыми числами - главным
Магнитное квантовое число ml. Определяет возможные значения проекции орбитального момента количества движения электрона на фиксированное направление в пространстве (например, на ось z). Оно принимает отрицательные и положительные значения l, включая нуль. Общее число значений равно 2l+1:
![]()
От значения магнитного квантового числа зависит взаимодействие магнитного поля, создаваемого электроном, с внешним магнитным полем. Если нет внешнего магнитного поля, то энергия электрона в атоме не зависит от ml. В этом случае электроны с одинаковыми значениями n и l, но с разными значениями ml обладают одинаковой энергией. Если существует внешнее магнитное поле – энергия электронов с разными ml различается.
В общем случае магнитное квантовое число характеризует ориентацию АО в пространстве относительно внешней силы. Магнитное квантовое число определяет ориентацию орбитального углового момента относительно некоторого фиксированного направления.
Общее число возможных значений ml соответствует числу способов расположения орбиталей данного подуровня в пространстве, то есть общему числу орбиталей на данном подуровне (табл. 2).
Таблица 2
Число орбиталей на подуровне
Главное квантовое число n |
Число значений ml |
Квантовое число |
|
l |
ml |
||
1
2
3 |
1
1 3
1 3 5 |
0 (s)
0 (s) 1 (p)
0 (s) 1 (p) 2 (d) |
0
0 -1, 0, +1
0 -1, 0, +1 -2, -1, 0, +1, +2 |
Орбитальному квантовому числу l =0 отвечает единственное значение магнитного квантового числа ml =0. Эти значения l и ml характеризуют все s-орбитали, которые имеют форму сферы. Так как в этом случае магнитное квантовое число принимает только одно значение, то каждый s-подуровень состоит только из одной орбитали. Рассмотрим любой р-подуровень. При l =1 орбитали имеют форму гантелей (объемные восьмерки), магнитное квантовое число принимает следующие значения: ml = -1, 0, +1. Следовательно, р-подуровень состоит из трех АО, которые располагаются вдоль осей координат, их обозначают px, py, pz соответственно (рис. 1).

Рис. 1. Пространственная форма s- и р-атомных орбиталей.
Для d-подуровня
l
=2, ml
= -2, -1, 0, +1, +2 (всего 5 значений), и любой
d-подуровень
состоит из пяти атомных орбиталей,
которые определенным образом расположены
в пространстве (рис.
2), и обозначаются
![]() соответственно.
соответственно.

Рис. 2. Пространственная форма d-атомных орбиталей.
Четыре из пяти
d-орбиталей
имеют форму четырехлепестковых розеток,
каждая из которых образована двумя
гантелями, пятая АО представляет собой
гантель с тором в экваториальной
плоскости (![]() -орбиталь)
и расположена вдоль оси z.
Лепестки орбитали
-орбиталь)
и расположена вдоль оси z.
Лепестки орбитали
![]() расположены вдоль осей x
и y.
Лепестки орбиталей
расположены вдоль осей x
и y.
Лепестки орбиталей
![]() расположены симметрично между
соответствующими осями.
расположены симметрично между
соответствующими осями.
Четвертый энергетический уровень состоит из четырех подуровней – s, p, d и f. Первые три из них аналогичны описанным выше, а четвертый f-подуровень состоит из семи АО, пространственная форма которых достаточно сложна и в данном разделе не рассматривается.
С. Гаудсмит и Дж.
Уленбек для описания некоторых тонких
эффектов в спектре атома водорода в
1925 г. выдвинули гипотезу о наличии
собственного момента импульса электрона,
который назвали спином.
Спин нельзя выразить через координаты
и импульсы, у него нет аналога в
классической механике. Спиновое число
s
электрона принимает только одно значение,
равное
![]() Проекция вектора спина на определенное
направление внешнего поля (например,
на ось z)
определяется спиновым
квантовым числом mS,
которое может принимать два значения:
mS
=
Проекция вектора спина на определенное
направление внешнего поля (например,
на ось z)
определяется спиновым
квантовым числом mS,
которое может принимать два значения:
mS
=![]()
Понятие «спин» введено для характеристики специфического квантового свойства электрона. Спин – это проявление релятивистских эффектов на микроскопическом уровне.
Электрон имеет
четыре степени свободы. Спиновое
квантовое число принимает только
дискретные значения:
![]() Таким образом, состояние электрона в
атоме определяется набором значений
четырех квантовых чисел: n,
l,
ml,
mS.
Таким образом, состояние электрона в
атоме определяется набором значений
четырех квантовых чисел: n,
l,
ml,
mS.
Обозначение и структура электронных энергетических уровней. Определим некоторые термины, которые используются для разъяснения физического смысла квантовых чисел. Группа орбиталей, имеющих одинаковое значение орбитального квантового числа, образует энергетический подуровень. Совокупность всех орбиталей с одинаковым значением главного квантового числа образует энергетический уровень.
Структуру атомных электронных уровней можно изобразить двояко: в виде электронных формул и электронографических диаграмм. При написании электронных формул используют два квантовых числа n и l: первый уровень – 1s; второй – 2s, 2p; третий – 3s, 3p, 3d; четвертый – 4s, 4p, 4d, 4f и т.д. (табл.3).
Таблица 3
Структура электронных энергетических уровней атома
Главное квантовое число n |
Обозначение подуровня |
Квантовое число |
|
l |
ml |
||
1 2
3
4 |
1s 2s 2p 3s 3p 3d 4s 4p 4d 4f |
0 0 1 0 1 2 0 1 2 3 |
0 0 -1, 0, +1 0 -1, 0, +1 -2, -1, 0, +1, +2 0 -1, 0, +1 -2, -1, 0, +1, +2 -3, -2, -1, 0, +1, +2, +3 |
Более полно строение электронных уровней описывается с использованием трех квантовых чисел: n, l, ml . Каждая АО условно изображается в виде квантовых ячеек, около которой ставится номер уровня и символ подуровня.
Строение многоэлектронных атомов.
Принципы построения электронной структуры атомов элементов.
В многоэлектронных атомах, как и в атоме водорода, состояние каждого электрона можно характеризовать квантовыми числами n, l, ml, mS. Межэлектронное отталкивание приводит к тому, что энергия электронов, имеющих одно и тоже значение n, но разные значения l, становится различной. Последовательность заполнения электронами подуровней в многоэлектронных атомах определяется принципом наименьшей энергии, принципом Паули и правилом Хунда.
Принцип наименьшей энергии гласит: заполнение электронами АО происходит в порядке возрастания их энергии. На основании изучения спектров атомов и квантово-механических расчетов установлена энергетическая диаграмма (рис.3) для различных АО в многоэлектронных нейтральных атомах, находящихся в основном состоянии (состоянии с наименьшей энергией).

Рис. 3. Энергетическая диаграмма атома водорода.
Последовательность АО в порядке возрастания их энергии имеет вид
![]()
Порядок возрастания энергии АО в сложных атомах описывается правилом (n+l) (или правилом Клечковского):
энергия АО возрастает в соответствии с увеличением суммы n+l главного и орбитального квантовых чисел. При одинаковом значении суммы, энергии меньше у АО с меньшим значением главного квантового числа.
Согласно принципу Паули, в атоме не может быть двух электронов с одинаковым набором четырех квантовых чисел. Каждый электрон в атоме имеет свой набор четырех квантовых чисел, который полностью определяет энергетическое состояние электрона. Так, для АО-1s существует два набора квантовых чисел:

Таблица 4
Сумма значений главного и орбитального квантовых чисел
Энергетический уровень n |
Энергетический подуровень |
n+l |
|
l |
Обозначение подуровня |
||
1 2
3
4
5 |
0 0 1 0 1 2 0 1 2 3 0 1 2 3 4 |
1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 5g |
1 2 3 3 4 5 4 5 6 7 5 6 7 8 9 |
Следовательно, на s-АО может находиться только два электрона с различными значениями спинового квантового числа.
Для каждой из трех 2р-АО также возможно только два набора квантовых чисел. Например, для одной из 2р-АО:

Значит, на р-подуровне любого уровня может находиться шесть электронов.
Таким образом, на одной орбитали могут находиться только два электрона с противоположными по знаку значениями спинового квантового числа. Два электрона, находящиеся на одной орбитали, то есть имеющие одинаковые значения квантовых чисел n, l, ml, но различные значения спинового квантового числа mS, называют спаренными. Принцип определения максимального числа электронов, которые могут находиться на уровне с главным квантовым числом, показан в табл.5.
Общее число орбиталей на энергетическом уровне со значение главного квантового числа n равно n2. Так как на одной орбитали может находиться лишь два электрона, получаем, что максимальная электронная емкость энергетического уровня составляет 2 n2.
Правило Хунда определяет последовательность заполнения АО электронами в пределах одного подуровня и формулируется следующим образом:
при данном значении квантового числа l (то есть в пределах одного подуровня) в основном состоянии электроны располагаются таким образом, что значение суммарного спина атома максимально.
Это означает, что на подуровне должно быть максимально возможное число неспаренных электронов.
Таблица 5
Максимальное число электронов на первых четырех энергетических уровнях
Энергетический уровень n |
l |
ml |
mS |
Число электронов |
|
на подуровне |
на уровне |
||||
1 2
3
4
|
0 (s) 0 (s) 1 (p) 0 (s) 1 (p) 2 (d) 0 (s) 1 (p) 2 (d) 3 (f) |
0 0 -1, 0, 1 0 -1, 0, 1 -2, -1, 0, 1, 2 0 -1, 0, 1 -2, -1, 0, 1, 2 -3, -2, -1, 0, 1, 2, 3 |
±1/2 ±1/2 ±1/2 ±1/2 ±1/2 ±1/2 ±1/2 ±1/2 ±1/2 ±1/2 |
2 2 6 2 6 10 2 6 10 14 |
2 8
18
32
|
Электронные конфигурации атомов элементов Периодической системы.
Распределение электронов по различным АО называют электронной конфигурацией атома. Электронная конфигурация с наименьшей энергией соответствует основному состоянию атома, остальные конфигурации относятся к возбужденным состояниям.
Электронную конфигурацию атома изображают двумя способами – в виде электронных формул и электронографических диаграмм. При написании электронных формул используют главное и орбитальное квантовые числа. Подуровень обозначают с помощью главного квантового числа (цифрой) и орбитального квантового числа (соответствующей буквой). Число электронов на подуровне характеризует верхний индекс. Например, для основного состояния атома водорода электронная формула: 1s 1.
Более полно строение электронных уровней можно описать с помощью электронографических диаграмм, где распределение по подуровням представляют в виде квантовых ячеек. Орбиталь в этом случае принято условно изображать квадратом, около которого проставлено обозначение подуровня. Подуровни на каждом уровне должны быть немного смещены по высоте, так как их энергия несколько различается. Электроны изображаются стрелками ↑ или ↓ в зависимости от знака спинового квантового числа. Электронографическая диаграмма атома водорода:
![]()
Принцип построения электронных конфигураций многоэлектронных атомов состоит в добавлении протонов и электронов к атому водорода. Распределение электронов по энергетическим уровням и подуровням подчиняются рассмотренным ранее правилам: принципу наименьшей энергии, принципу Паули и правилу Хунда.
С учетом структуры электронных конфигураций атомов все известные элементы в соответствии со значением орбитального квантового числа последнего заполняемого подуровня можно разбить на четыре группы: s-элементы, p-элементы, d-элементы, f-элементы.
В атоме гелия Не (Z=2) второй электрон занимает 1s-орбиталь, его электронная формула: 1s 2. Электронографическая диаграмма:

Гелием заканчивается первый самый короткий период Периодической системы элементов. Электронную конфигурацию гелия обозначают [He].
Второй период
открывает литий Li
(Z=3),
его электронная формула:
![]() Электронографическая диаграмма:
Электронографическая диаграмма:

Далее приведены упрощенные электронографические диаграммы атомов элементов, орбитали одного энергетического уровня которых расположены на одной высоте. Внутренние, полностью заполненные подуровни, не показаны.
После лития следует бериллий Ве (Z=4), в котором дополнительный электрон заселяет 2s-орбиталь. Электронная формула Ве: [He] 2s 2

В основном состоянии следующий электрон бора В (z=5) занимает 2р-орбиталь, В:1s22s22p1; его электронографическая диаграмма:

Следующие пять элементов имеют электронные конфигурации:
С (Z=6): [He] 2s 22p 2 N (Z=7): [He] 2s 22p 3

O (Z=8): [He] 2s 22p 4 F (Z=9): [He] 2s 22p 5

Ne (Z=10): [He] 2s 22p 6

Приведенные электронные конфигурации определяются правилом Хунда.
Первый и второй энергетические уровни неона полностью заполнены. Обозначим его электронную конфигурацию [Ne] и будем использовать в дальнейшем для краткости записи электронных формул атомов элементов.
Натрий Na (Z=11) и Mg (Z=12) открывают третий период. Внешние электроны занимают 3s-орбиталь:
Na (Z=11): [Ne] 3s 1
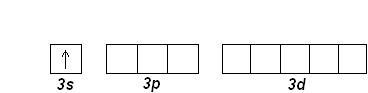
Mg (Z=12): [Ne] 3s 2

Затем, начиная с алюминия (Z=13), заполняется 3р-подуровень. Третий период заканчивается аргоном Ar (Z=18):
Al (Z=13): [Ne] 3s 23p 1


Ar (Z=18): [Ne] 3s 23p 6
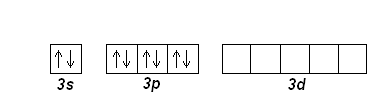
Элементы третьего периода отличаются от элементов второго тем, что у них имеются свободные 3d-орбитали, которые могут участвовать в образовании химической связи. Это объясняет проявляемые элементами валентные состояния.
В четвертом периоде, в соответствии с правилом (n+l), у калия К (Z=19) и кальция Са (Z=20) электроны занимают 4s-подуровень, а не 3d.Начиная со скандия Sc (Z=21) и кончая цинком Zn (Z=30), происходит заполнение3d-подуровня:
![]()
Электронные формулы
d-элементов
можно представить в ионном виде: подуровни
перечисляются в порядке возрастания
главного квантового числа, а при
постоянном n
– в порядке увеличения орбитального
квантового числа. Например, для Zn
такая запись будет выглядеть так:
![]() Обе эти записи эквивалентны, но приведенная
ранее формула цинка правильно отражает
порядок заполнения подуровней.
Обе эти записи эквивалентны, но приведенная
ранее формула цинка правильно отражает
порядок заполнения подуровней.
В ряду 3d-элементов
у хрома Сr
(Z=24)
наблюдается отклонение от правила
(n+l).
В соответствии с этим правилом конфигурация
Сr
должна выглядеть так:
![]() Установлено, что его реальная конфигурация
-
Установлено, что его реальная конфигурация
-
![]() Иногда этот эффект называют «провалом»
электрона. Подобные эффекты объясняются
повышенной устойчивостью наполовину
(p
3,
d
5,
f
7)
и полностью (p
6,
d
10,
f
14)
заполненных подуровней.
Иногда этот эффект называют «провалом»
электрона. Подобные эффекты объясняются
повышенной устойчивостью наполовину
(p
3,
d
5,
f
7)
и полностью (p
6,
d
10,
f
14)
заполненных подуровней.
Отклонения от правила (n+l) наблюдаются и у других элементов (табл. 6). Это связано с тем, что с увеличение главного квантового числа различия между энергиями подуровней уменьшаются.
Далее происходит заполнение 4p-подуровня (Ga - Kr). В четвертом периоде содержится всего 18 элементов. Аналогично происходит заполнение 5s-, 4d- и 5p- подуровней у 18-ти элементов пятого периода. Отметим, что энергия 5s- и 4d-подуровней очень близки, и электрон с 5s-подуровня может легко переходить на 4d-подуровень. На 5s-подуровне у Nb, Mo, Tc, Ru, Rh, Ag находится только один электрон. В основном состоянии 5s-подуровень Pd не заполнен. Наблюдается «провал» двух электронов.
В шестом периоде после заполнения 6s-подуровня у цезия Cs (Z=55) и бария Ba (Z=56) следующий электрон, согласно правилу (n+l), должен занять 4f-подуровень. Однако у лантана La (Z=57) электрон поступает на 5d-подуровень. Заполненный на половину (4f7) 4f-подуровень обладает повышенной устойчивостью, поэтому у гадолиния Gd (Z=64), следующего за европием Eu (Z=63), на 4f-подуровне сохраняется прежнее количество электронов (7), а новый электрон поступает на 5d-подуровень, нарушая правило (n+l). У тербия Tb (Z=65) очередной электрон занимает 4f-подуровень и происходит переход электрона с 5d-подуровня (конфигурация 4f96s2). Заполнение 4f-подуровня заканчивается у иттербия Yb (Z=70). Следующий электрон атома лютеция Lu занимает 5d-подуровень. Его электронная конфигурация отличается от конфигурации атома лантана только полностью заполненным 4f-подуровнем.
Таблица 6
Исключения из (n+l) – правила для первых 86 элементов
Элемент |
Электронная конфигурация |
|
по правилу (n+l) |
фактическая |
|
Cr (Z=24) Cu (Z=29) Nb (Z=41) Mo (Z=42) Tc (Z=43) Ru (Z=44) Rh (Z=45) Pd (Z=46) Ag (Z=47) La (Z=57) Ce (Z=58) Gd (Z=64) Ir (Z=77) Pt (Z=78) Au (Z=79) |
[Ar] 4s 23d 4 [Ar] 4s 23d 9 [Kr] 5s 24d 3 [Kr] 5s 24d 4 [Kr] 5s 24d 5 [Kr] 5s 24d 6 [Kr] 5s 24d 7 [Kr] 5s 24d 8 [Kr] 5s 24d 9 [Xe] 6s 24f 15d 0 [Xe] 6s 24f 25d 0 [Xe] 6s 24f 85d 0 [Xe] 6s 24f 145d 7 [Xe] 6s 24f 145d 8 [Xe]6s 24f 145d 9 |
4s 13d 5 4s 13d 10 5s 14d 4 5s 14d 5 5s 14d 6 5s 14d 7 5s 14d 8 5s 04d 10 5s 14d 10 6s 24f 05d 1 6s 24f 15d 1 6s 24f 75d 1 6s 04f 145d 9 6s 14f 145d 9 6s14f145d10 |
В настоящее время в Периодической системе элементов Д.И. Менделеева под скандием Sc и иттрием Y располагаются иногда лютеций (а не лантан) как первый d-элемент, а все 14 элементов перед ним, включая лантан, вынося в особую группу лантаноидов за пределы Периодической системы элементов.
Химические свойства элементов определяются, главным образом, структурой внешних электронных уровней. Изменение числа электронов на третьем снаружи 4f-подуровне слабо отражается на химических свойствах элементов. Поэтому все 4f-элементы схожи по своим свойствам. Затем в шестом периоде происходит заполнение 5d-подуровня (Hf – Hg) и 6p-подуровня (Tl – Rn).
В седьмом периоде 7s-подуровень заполняется у франция Fr (Z=87) и радия Ra (Z=88). У актиния наблюдается отклонение от правила (n+l), и очередной электрон заселяет 6d-подуровень, а не 5f. Далее следует группа элементов (Th – No) с заполняющимся 5f-подуровнем, которые образуют семейство актиноидов. Отметим, что 6d- и 5f- подуровни имеют столь близкие энергии, что электронная конфигурация атомов актиноидов часто не подчиняется правилу (n+l). Но в данном случае значение точной конфигурации 5f т5d m не столь важно, поскольку она довольно слабо влияет на химические свойства элемента.
У лоуренсия Lr (Z=103) новый электрон поступает на 6d-подуровень. Этот элемент иногда помещают в Периодической системе под лютецием. Седьмой период не завершен. Элементы 104 – 109 неустойчивы и их свойства малоизвестны. Таким образом, с ростом заряда ядра периодически повторяются сходные электронные структуры внешних уровней. В связи с этим следует ожидать и периодического изменения различных свойств элементов.
Отметим, что описанные электронные конфигурации относятся к изолированным атомам в газовой фазе. Конфигурация атома элемента может быть совершенно иной, если атом находится в твердом теле или растворе.
