
- •Ответы на билеты по химии
- •1. Периодический закон и периодическая система химических элементов д. И. Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки.
- •2. Предельные углеводороды
- •Строение молекулы метана
- •Разложение
- •Билет №2
- •2. Непредельные углеводороды ряда этилена (алкены)
- •1. Строение алкенов
- •Физические и химические свойства :
- •Отдельные представители
- •Билет №3.
- •1. Виды химической связи и способы ее образования в неорганических соединениях: ковалентная (полярная, неполярная, простые и кратные связи), ионная, водородная.
- •Химические свойства
- •1. Классификация химических реакций
- •2. Крахмал, целлюлоза
- •Билет 5.
- •1. Обратимость химических реакций, химическое равновесие
- •2. Ацетилен…
- •1. Скорость химических реакций
- •Катализ и катализаторы
- •2. Ароматические углеводороды (арены)
- •1. Основные положения теории химического строения а.М. Бутлерова
- •1. Изомерия органических соединений и ее виды.
- •2. Классификация оксидов
- •1. Металлы, их положение в периодической системе химических элементов д. И. Менделеева, строение их атомов, металлическая связь. Общие химические свойства металлов.
- •2. Фенол…
- •2. Предельные одноатомные спирты
- •2. Жиры, их состав и свойства. Жиры в природе, превращение жиров в организме. Продукты технической переработки жиров, понятие о синтетических моющих средствах.
- •1. Кислоты, их классификация и химические свойства на основе представлений об электролитической диссоциации. Особенности свойств концентрированной серной кислоты на примере взаимодействия с медью.
- •2. Общая характеристика высокомолекулярных соединений: состав, строение, реакции, лежащие в основе их получения (на примере полиэтилена или синтетического каучука).
- •1. Основания, их классификация и химические свойства на основе представлений об электролитической диссоциации.
- •2. Глюкоза — представитель моносахаридов, химическое строение, физические и химические свойства, применение.
- •1. Средние соли, их состав, названия, химические свойства (взаимодействие с металлами, кислотами, щелочами, друг с другом с учетом особенностей реакций окисления-восстановления и ионного обмена).
- •2. Взаимное влияние атомов в молекулах органических веществ на примере этанола и фенола.
- •Алюминий…
- •2. Анилин
- •Физические свойства
- •Важнейшие химические свойства анилина
- •Применение
- •2. Белки
- •Структура белка
- •Физические свойства
- •Химические свойства
- •Функции белков в организме
1. Основные положения теории химического строения а.М. Бутлерова
Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения).
Химическое строение можно устанавливать химическими методами. (В настоящее время используются также современные физические методы).
Свойства веществ зависят от их химического строения.
По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы - предвидеть свойства.
Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга.
Теория Бутлерова явилась научным фундаментом органической химии и способствовала быстрому ее развитию. Опираясь на положения теории, А.М. Бутлеров дал объяснение явлению изомерии, предсказал существование различных изомеров и впервые получил некоторые из них.
Развитию теории строения способствовали работы Кекуле, Кольбе, Купера, Жерара и Вант-Гоффа. Однако их теоретические положения не носили общего характера и служили, главным образом, целям объяснения экспериментального материала.
Билет 8.
1. Изомерия органических соединений и ее виды.

2. Классификация оксидов
Оксиды подразделяются на солеобразующие и несолеобразующие.

Солеобразующими
называют такие оксиды, которые в
результате химических реакций способны
образовывать соли. Несолеобразующие
оксиды такой способностью не обладают.
Примером несолеобразующих оксидов
могут служить следующие вещества:
![]() ,
,
![]() ,
,
![]() .
Солеобразующие оксиды, в свою очередь
подразделяются на основные, кислотные
и амфотерные.
.
Солеобразующие оксиды, в свою очередь
подразделяются на основные, кислотные
и амфотерные.
Основными оксидами называются такие оксиды, которым в качестве гидратов (продуктов присоединения воды) соответствуют основания.
Например:
основные оксиды |
соответствующая |
|
гидратная форма |
|
(основание) |
|
|
|
|
|
|
|
|
Основные оксиды образуют металлы при проявлении ими невысокой валентности (обычно I или II).
Оксиды
таких металлов, как
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() взаимодействуют
с водой с образованием растворимых в
воде оснований - щелочей. Другие основные
оксиды непосредственно с водой не
взаимодействуют, а соответствующие им
основания получают из солей (косвенным
путем).
взаимодействуют
с водой с образованием растворимых в
воде оснований - щелочей. Другие основные
оксиды непосредственно с водой не
взаимодействуют, а соответствующие им
основания получают из солей (косвенным
путем).
Кислотными оксидами называются такие оксиды, которым в качестве гидратов соответствуют кислоты. Кислотные оксиды называют также ангидридами кислот.
Например:
кислотные оксиды |
соответствующая |
|
гидратная форма |
|
(кислота) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Кислотные оксиды образуют неметаллы и металлы при проявлений ими высокой валентности. Например, оксид марганца (VII) - кислотный оксид, так как в качестве гидрата ему соответствует кислота и это оксид металла с высокой валентностью.
Большинство кислотных оксидов могут взаимодействовать с водой непосредственно и при этом образовывать кислоты.
Например:
![]() ,
,
![]() ,
,
![]() .
.
Некоторые оксиды непосредственно с водой не взаимодействуют. Такого типа оксиды сами могут быть получены из кислот. Например:
![]() (температура)
(температура)
Это подтверждает названия кислотных оксидов - ангидриды, то есть "не содержащие воду".
Амфотерные оксиды представляют собой оксиды, которые в зависимости от условий проявляют свойства как основных (в кислой среде), так и кислотных (в щелочной среде) оксидов. К амфотерным оксидам относятся оксиды некоторых металлов.
Например:
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
а) В кислой среде (оксид свинца (II))
.
а) В кислой среде (оксид свинца (II))
![]() ,
проявляет
свойства основного оксида
б) в
щелочной среде
проявляет
свойства кислотного оксида.
,
проявляет
свойства основного оксида
б) в
щелочной среде
проявляет
свойства кислотного оксида.
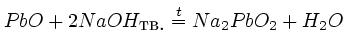 ,
,
Амфотерные
оксиды с водой непосредственно не
взаимодействуют, следовательно, их
гидратные формы получают косвенно - из
солей. Несолеобразующие (индифферентные)
оксиды - небольшая группа оксидов, не
вступающая в химические реакции с
образованием солей. К ним относятся:
,
,
,
![]() .
.
Билет 9.
