
- •1. Предмет технической термодинамики и ее задачи
- •2Основные параметры состояния газа
- •3. Законы идеальных газов. Уравнение состояния идеального газа
- •4. Газовые смеси
- •5. Эквивалентность теплоты и работы
- •6 Термодинам. Проц.
- •7 Внутренняя энергии газа
- •8 Работа Расширения
- •9 Определения. Истинная и средняя теплоемкость
- •10 Изобарная и изохорная теплоемкость идеального газа
- •11 Зависимость теплоемкости газов от температуры
- •12 Теплоёмкость смеси газов
- •13 Основные термодинамические процессы.
4. Газовые смеси
В энергетике и в других отраслях промышленности в большинстве случаев в качестве рабочего тела juih теплоносителя используются не однородные газы, а га-зовыецрмеси. Такими газовыми смесями являются продукты сгорания различных топлив^в топках парогенераторов, в камерах сгорания газо^^Оинных ус^новок и у в цилиндрах двигателей внутреннего сгораййя. Типичными "представителями газовых смесей можно считать также природные газы, газы, являющиеся побочными продуктами различных технологических процессов, и, наконец, атмосферный воздух7\,г
Все эти газы являются механическими смесями, в которых никаких химических реакций не происходит. Эти газовые смеси рассматриваются как смеси идеальных газов, подчиняющихся законам идеальных газов и уравнению Менделеева — Клапейрона. Каждый газ, входящий в смесь, занимает объем смеси, имеет темпера-, * туру смеси, но Находится под своим давлением, которое называется парциальным. |
По закону Дальтона давление смеси йгазов равно сумме парциальных давлений:
р=р1+р2+…+рn
Составляющие газовую смесь однородные газы называются компонентами газовой смеси. Если при температуре смеси поднять давление какого-либо компонента от парциального до давления смеси, то этот компонент займет объем, который называется парциальным.
Способы задания смеси. При расчетах с газовыми смесями необходимо знать значения «ряда величин, характеризующих смесь, например: газовую постоянную смеси, плотность, молекулярную массу и др. Чтобы можно было найти необходимые характеристики, нужно знать состав газовой смеси. Состав смеси может быть задан или массами компонентов и их объемами, или массовыми и объемными долями.
Пусть газовая смесь состоит из п компонентов, массы которых равны т1, т2, ..., шп соответственно для первого, второго и т. д. компонентов. Так как в смеси не происходит никаких химических реакций, то масса смеси т равна сумме масс компонентов
т=т1 +т2+.. .+тп.
Отношение массы компонента тi к массе смеси т есть массовая доля этого компонента, дна обозначается gi т. е.
g1=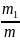 g2=
g2=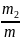
месь может быть задана объемами компонентов Vu взятыми при давлении и температуре смеси, т. е. парциальными объемами. Пусть Vi, V2, Vn — соответственно парциальные объемы первого, второго и т. д. компонентов, тогда объем смеси V равен их сумме, т. е.
V=V1 + V2 + ... + Vn.
Отношение парциального объема компонента к объему смеси называется его объемной долей и обозначается ri
r1=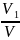 r2=
r2=
Между массовыми и объемными долями существуют простые соотношения, которые имеют вид:
gi=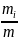 =
=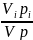 =ri
=ri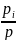 =
ri
=
ri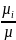 =
ri
=
ri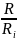
Плотность( )Пусть смесь состоит из п компонентов. Из уравнения для каждого компонента можно написать:
g1=r1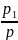 g2=r2
g2=r2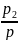 gn=r2
gn=r2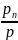
Суммируя почленно левые и правые части всех соотношений с учетом уравнения получаем:
g1+
g2+….+
gn=1=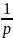 (r1
+r2
+…+
rn
(r1
+r2
+…+
rn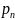 )
)
=r1* + r2* +….+ rn*
причем
плотности компонентов
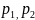 ,
,
должны быть взяты при температуре и давлении смеси.
Кажущаяся молекулярная масса смеси µ.Согласно закону Авогадро плотности газов пропорциональны их молекулярным массам, поэтому после замены на µ уравнение (1-30) приводится к виду:
µ=
r1*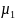 +
r2*
+
r2*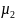 +….+
rn*
+….+
rn*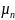
Газовая постоянная R. Из уравнения (1-28) для каждого компонента имеем:
g1=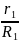 R
g2=
R
g2=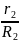 R
gn=
R
gn=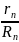 R
R
R=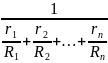
Газовую постоянную смеси можно также определить по уравнению:
R=
=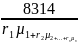
Парциальное давление pi. Любой компонент газовой смеси занимает объем смеси V, но находится под своим парциальным давлением рi, если же при постоянной температуре смеси поднять его давление pi до давления смеси р, то объем компонента уменьшится до парциального Vi. Используя закон Бойля — Мариотта, можно написать:
Pi*V=ViP
Pi=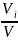 P=riP
P=riP
т. е. парциальное давление компонента определяемся как произведение его объемной доли на давление смеси.
Основные формулы для определения параметров смеси при задании смеси массовыми долями имеют следующий вид.
Плотность . Пусть смесь состоит из п компонентов. Для каждого компонента из уравнения (1-29) можно написать:
r1=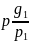 r2=
r2=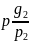 rn=
rn=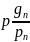
=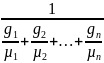
Газовая постоянная R. Из уравнения (1-29)
R=g1R1+ g2R2+…+ gnRn
Парциальное давление Pi. Напишем уравнение состояния для компонента
PiV=miRiT
для смеси газов
PV=mRT
Разделив уравнение (а) на (б) и выполнив элемент тарные преобразования, получим необходимое уравнение для определения парциального давления
Pi=gi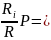 gi
gi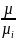 P
P
