
- •30.Способы выражения состава раствора (массовая доля, молярность, моляльность, нормальность).
- •24 . Обратимые и необратимые реакции. Химическое равновесие; константа равновесия, влияние температуры на константу равновесия. Принцип Ле-Шателье.
- •33. Рауля.
- •32. Диффузия и осмос , Осмотическое давление. Законы Вант-Гоффа
- •35.Электролитическая диссоциация
- •34.Коллигативные свойства растворов
- •31. Коэффициент растворимости веществ. Разбавленные и концентрированные, насыщенные и ненасыщенные растворы.
- •37 Ионные равновесия в растворах электролитов
- •[Править]Ионные реакции в органической химии
- •23.Понятия:катализатор,ингибитор,промотор,фермент.
- •22.Катализ (гомогенный, гетерогенный, ферментативный). Понятия о механизме каталитических процессов.
- •26. Растворы как многокомпонентные системы. Понятие растворитель, растворённое вещество.
1-ый
Закон Рауля:
относительное понижение давления
насыщенного пара растворителя над
раствором равно мольной доле растворённого
вещества:
Поскольку температура
кипения и температура замерзания
зависит от давления насыщенного пара,
то понижение давления пара над
раствором
неэлектролита повышает температуру
кипения и понижает температуру
замерзания. 2-ой
закон Рауля:
повышение температуры кипения и
понижение температуры замерзания
раствора неэлектролита пропорциональны
моляльной концентрации растворённого
вещества.
Э
и К зависят от природы растворителя.
25. С
увеличением температуры,
для эндотермической
реакции возрастает
для экзотермической
реакции убывает
для T
= const
остаётся постоянным
Влияние различных
факторов на положение химического
равновесия определяется принципом
Ла-Шателье:
если на систему, находящуюся в равновесии,
оказать какое-либо воздействие, то в
системе усиливаются процессы, стремящиеся
уменьшить это воздействие. В
состоянии равновесия
Вещества, которые
диспергированы в растворе в виде
молекул – неэлектролиты.
Растворение – не чисто механический
процесс, связанный с простым дроблением
и вещества и его распределением в
растворе. При растворении происходит
уменьшение свободной энергии Гиббса
В разбавленных
растворах неэлектролитов
можно пренебречь силами межмолекулярного
взаимодействия между молекулами
растворяемого вещества. Их можно
рассматривать как результат механического
смешивания компонентов, не сопровождающегося
тепловым эффектом
(
Процесс
самопроизвольного переноса вещества,
приводящий к установлению равновесия
концентрации, называется диффузией.
Движущей энергией диффузии является
стремление молекул обоих компонентов
к равномерному распределению по всему
объёму.
Односторонняя
диффузия через полупроницаемую мембрану
называют осмосом
(например, проникновение
Пар, находящийся
в равновесии с жидкостью называется
насыщенным.
Каждая жидкость имеет определённое
давление насыщенного пара, которое
увеличивается с увеличением температуры.
Жидкость закипает тогда, когда давление
пара становится равным атмосферному
давлению:
Давление пара над
раствором всегда меньше давления пара
над растворителем.
33. Рауля.
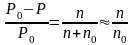
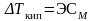 ,
где Э – эбулиоскопическая
постоянная
,
где Э – эбулиоскопическая
постоянная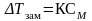 ,
где K
– криоскопическая
постоянная
,
где K
– криоскопическая
постоянная
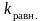 :
: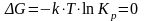 .
.32. Диффузия и осмос , Осмотическое давление. Законы Вант-Гоффа
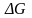 ,
Растворение идёт до тех пор, пока не
наступит динамическое равновесие
между растворяемым веществом и
растворителем, т.е. пока
,
Растворение идёт до тех пор, пока не
наступит динамическое равновесие
между растворяемым веществом и
растворителем, т.е. пока
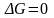 .
Такой раствор называется насыщенный.
.
Такой раствор называется насыщенный.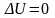 и
и
 ).
).
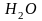 в сахарозу). Давление, которое необходимо
приложить к раствору, чтобы прекратился
осмос, называется осмотическим
давлением.
Растворы с одинаковым осмотическим
давлением называются изотоническими.
Осмотическое давление раствора
неэлектролита пропорционально
концентрации растворённого вещества
и абсолютной температуре. Закон
Вант-Гоффа:
в сахарозу). Давление, которое необходимо
приложить к раствору, чтобы прекратился
осмос, называется осмотическим
давлением.
Растворы с одинаковым осмотическим
давлением называются изотоническими.
Осмотическое давление раствора
неэлектролита пропорционально
концентрации растворённого вещества
и абсолютной температуре. Закон
Вант-Гоффа:
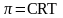 .
.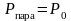 .
.
