
- •30.Способы выражения состава раствора (массовая доля, молярность, моляльность, нормальность).
- •24 . Обратимые и необратимые реакции. Химическое равновесие; константа равновесия, влияние температуры на константу равновесия. Принцип Ле-Шателье.
- •33. Рауля.
- •32. Диффузия и осмос , Осмотическое давление. Законы Вант-Гоффа
- •35.Электролитическая диссоциация
- •34.Коллигативные свойства растворов
- •31. Коэффициент растворимости веществ. Разбавленные и концентрированные, насыщенные и ненасыщенные растворы.
- •37 Ионные равновесия в растворах электролитов
- •[Править]Ионные реакции в органической химии
- •23.Понятия:катализатор,ингибитор,промотор,фермент.
- •22.Катализ (гомогенный, гетерогенный, ферментативный). Понятия о механизме каталитических процессов.
- •26. Растворы как многокомпонентные системы. Понятие растворитель, растворённое вещество.
Раствор
– газообразная, твёрдая или жидкая
гомогенная система состоящая из 2-х или
более элементов относительное содержание
которых может изменяться в неограниченных
пределах. Он состоит из растворённого
вещества и растворителя,
в котором это вещество равномерно
распределено в виде молекул и ионов.
Важной характеристикой
любого раствора является его состав,
который выражается концентрацией.
Массовая доля
– отношение массы растворённого
вещества X
к общей массе раствора m
:
Мольная доля
– отношение количества растворённого
вещества X
к сумме количеств всех компонентов в
растворе:
Молярная
концентрация
– отношение количества растворённого
вещества к объёму раствора:
Эквивалентная
(нормальная) концентрация
– отношение количества эквивалентов
растворённого вещества к объёму
раствора:
Химическим
эквивалентом
называется некоторая условная или
реальная частица, которая может в
реакциях присоединить или высвободить
1 ион водорода:
Моляльная
концентрация
– отношение количества растворённого
вещества к массе растворителя:
Поскольку
ни количество вещества, ни его масса
не зависят от температуры,
то и моляльность (в отличие от молярности)
температурной зависимостью
не обладает.
Многочисленность
способов выражения концентрации
растворов обусловлена
разнообразием практических задач. В
простейших случаях наиболее
проста и надежна массовая доля. Если
же объектом исследования является
механизм сложного химического
взаимодействия между ионами в растворе,
необходимо знать точное соотношение
количеств ионов – в этом случае
целесообразно использовать молярную
концентрацию. Если же при этом необходим
еще и учет сольватационных процессов
с участием растворителя, то наиболее
удобной оказывается концентрация,
выраженная в мольных долях.
Следует
отметить, что приведенные выше формулы
позволяют осуществлять
переход от одного способа выражения
содержания растворенного вещества
в растворе к другому, а также находить
неизвестные величины для расчета
одного из них по данным для другого.
Реакции, которые
протекают только в одном направлении
и идут до конца – необратимые
(образование осадка, выделение газа).
Их мало.
Большинство реакций
– обратимые:
Согласно
закону действия масс:
Состояние системы,
в которой
Активированный
комплекс
Энергия для перевода
молекулы в активное состояние – энергия
активации
Изменение Е в ходе
реакции: Е
выделяется (экзотермическая)
С
увеличением температуры число активных
молекул растёт, поэтому
увеличивается.
Константа
химической реакции связана с
:
Больше 3-х не бывает,
т.к. столкновение более 3-х частиц сразу
– маловероятно. Зависимость
скорости реакции от температуры
определяется эмпирическим правилом
Вант-Гоффа:
при увеличении температуры на
17.
Энергия активации (активированный
комплекс, энергетические диаграммы
экзо- и эндотермических реакций, влияние
катализаторов, уравнение Аррениуса).
Катализ (гомогенный и гетерогенный;
ферменты, промоторы, ингибиторы).
Не всякое столкновение
молекул сопровождается их взаимодействием.
Большинство молекул отскакивают как
упругие шарики. И только активные при
столкновении взаимодействуют друг с
другом. Активные молекулы обладают
некоторой избыточной Е по сравнению с
неактивными молекулами, поэтому в
активных молекулах связи между ними
ослаблены.
Скорость химических
реакций зависит:
от природы
реагирующих веществ, от концентрации
реагентов, от катализатора, от
температуры, от степени измельчения
твёрдого вещества (гетерогенные
реакции), от среды (растворы), от формы
реактора (цепные реакции), от освещения
(фотохимические реакции)
Основной
закон химической кинетики – закон
действующих масс:
скорость химической реакции
пропорциональна произведению
концентраций реагирующих веществ в
реакции
Физический
смысл
Если
в реакции участвуют не 2-е частицы, а
более
Число
частиц, участвующих в этом акте реакции
определяет молекулярность
реакции:


30.Способы выражения состава раствора (массовая доля, молярность, моляльность, нормальность).
 (обычно выражается в процентах %)
(обычно выражается в процентах %) ,
где
,
где
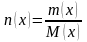 – молярная масса для 2-х компонентов.
– молярная масса для 2-х компонентов.
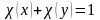
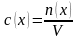 (выражается в
(выражается в
 ,
например, 2 М
,
например, 2 М
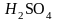 ,
в единице раствора 2 моля
).
,
в единице раствора 2 моля
).
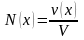 (выражается в
(выражается в
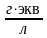 )
)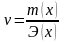 ,
где
,
где
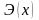 – эквивалентная масса
– эквивалентная масса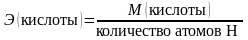
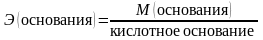
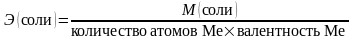
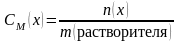 (выражается в
(выражается в
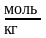 ).
).24 . Обратимые и необратимые реакции. Химическое равновесие; константа равновесия, влияние температуры на константу равновесия. Принцип Ле-Шателье.
 .
.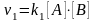
![]()
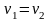 – химическое
равновесие.
– химическое
равновесие.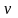 прямой реакции =
обратной реакции, называется химическим
равновесием.
прямой реакции =
обратной реакции, называется химическим
равновесием.
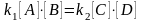
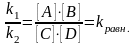
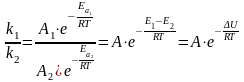
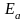 .
Чем она меньше, тем больше частиц
реагируют, тем больше скорость химической
реакции.
.
Чем она меньше, тем больше частиц
реагируют, тем больше скорость химической
реакции.
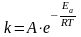 ,
где
,
где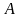 – предэкспоненциальный
множитель (связан с вероятностью и
числом столкновений).
– предэкспоненциальный
множитель (связан с вероятностью и
числом столкновений). мономолекулярная
(
мономолекулярная
(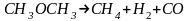 )
)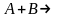 бимолекулярная(
бимолекулярная(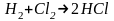 )
)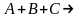 тримолекулярная
тримолекулярная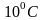 ,
скорость химической реакции увеличивается
в 2 – 4 раза:
,
скорость химической реакции увеличивается
в 2 – 4 раза: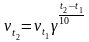
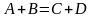 :
:
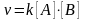 ,
где k
– постоянная скорости химической
реакции
,
где k
– постоянная скорости химической
реакции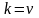 при
при
 .
.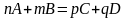 ,
то:
~
,
то:
~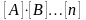 в степенях, равных стехиометрическим
коэффициентам, т.е.:
в степенях, равных стехиометрическим
коэффициентам, т.е.:
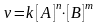 ,
где
,
где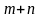 – показатель
порядка реакции в целом (реакции
первого, второго, третьего … порядков).
– показатель
порядка реакции в целом (реакции
первого, второго, третьего … порядков).
