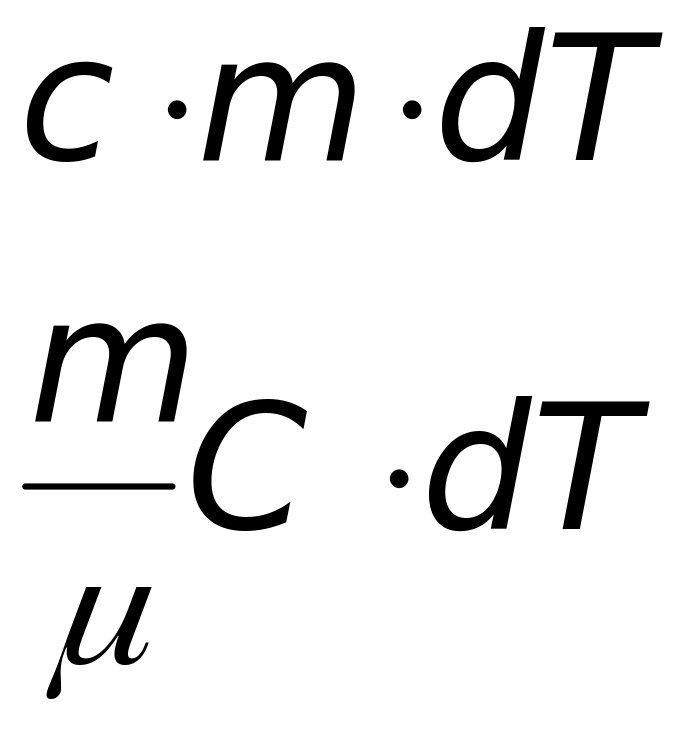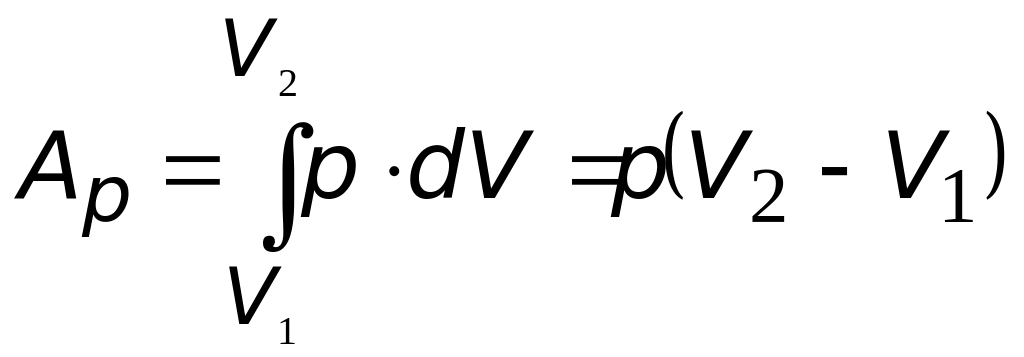Тема 15.
ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ. ПЕРВОЕ НАЧАЛО
ТЕРМОДИНАМИКИ
Термодинамика – это раздел физики, в котором рассматриваются любые процессы (механические, электрические, магнитные, химические и др.) с учетом сопровождающих их тепловых явлений. Термодинамика, как и молекулярная физика, применима только к системам, состоящим из очень большого числа частиц (нельзя применять законы термодинамики к 2-3 молекулам). В термодинамике не рассматривается поведение частиц внутри системы. Вся система изучается в целом и характеризуется едиными для системы характеристиками, например, теплоемкостью, диэлектрической или магнитной проницаемостью и пр.
В основе термодинамики лежат два начала (закона), полученные на основе опытных данных. I начало термодинамики – это по существу закон сохранения энергии с учетом тепловых явлений, II начало термодинамики определяет направление протекания физических процессов. И первое, и второе начало термодинамики имеют по нескольку формулировок. Но вначале мы должны ввести основные понятия, которые используются в термодинамике.
Термодинамическая система - это система, состоящее из большого числа частиц. Состояние системы описывается макропараметрами температура, давление, объем, намагниченность и многие другие. Термодинамическое равновесие или состояние термодинамического равновесия – это состояние, в которое самопроизвольно приходит система, находящаяся в неизменных внешних условиях. В состоянии равновесия макроскопические параметры состояния (например, p,V,T) остаются неизменными, хотя микроскопические характеристики частиц системы все время меняются.
 Процессом
называется переход из одного равновесного
состояния в другое, сопровождающийся
изменением хотя бы одного параметра. В
термодинамике обычно рассматривается
идеализированный процесс, который
называется обратимым
процессом
это такой
процесс перехода системы из состояния
А
в состояние В,
при котором возможен обратный переход
от В
к А через
те же промежуточные состояния и при
этом в окружающих телах не происходит
никаких изменений. Система называется
изолированной,
если она не обменивается энергией с
окружающей средой. На графике состояния
обозначаются точками, а процессы –
линиями.
Процессом
называется переход из одного равновесного
состояния в другое, сопровождающийся
изменением хотя бы одного параметра. В
термодинамике обычно рассматривается
идеализированный процесс, который
называется обратимым
процессом
это такой
процесс перехода системы из состояния
А
в состояние В,
при котором возможен обратный переход
от В
к А через
те же промежуточные состояния и при
этом в окружающих телах не происходит
никаких изменений. Система называется
изолированной,
если она не обменивается энергией с
окружающей средой. На графике состояния
обозначаются точками, а процессы –
линиями.
Величины, которые
зависят только от состояния системы и
не зависят от процессов, посредством
которых система пришла в данное состояние,
называются функциями
состояния.
К таким величинам относятся: внутренняя
энергия U,
энтропия S,
температура Т
и др. Бесконечно
малое изменение таких величин обозначают
как dU,
dS,
т.е. знаком полного дифференциала «d».
Величины, значения которых в данном
состоянии зависят от предшествующих
процессов, называются функциями
процессов
это теплота Q
и работа A,
их изменение
обозначают часто как Q,
A
или
![]() .
(
- греческая
буква - дельта)
.
(
- греческая
буква - дельта)
Работа и теплота – это две формы передачи энергии от одних тел к другим. При совершении работы меняется относительное расположение тел или частей тела. Передача энергии в виде теплоты осуществляется при контакте тел – за счет теплового движения молекул.
|
|
количество теплоты, передаваемое при нагревании (охлаждении) тела. Формулы получены опытным путем и применимы к газам, жидкостям и твердым телам |
с (Дж/кг.К) |
удельная теплоемкость - по смыслу – это количество теплоты, необходимое для нагревания единичной массы на один градус |
|
С (Дж/кмоль.К) |
молярная теплоемкость это количество теплоты, необходимое для нагревания одного киломоля (или моля) вещества на один градус |
|
|
связь между молярной и удельной теплоемкостями |
|
Для жидкостей и твердых тел теплоемкость практически не зависит от давления и объема. Для газов теплоемкость оказывается различной в зависимости от того, как производится процесс – при постоянном давлении или постоянном объеме, поэтому вводят Ср и СV.(см. дальше).
|
работа в газах (по определению): ( «+»А – работа газа «»А – работа внешних сил над газом |
|
|
|
только при постоянном давлении |
||
К внутренней энергии относят: 1)кинетическую энергию теплового движения молекул (но не кинетическую энергию всей системы в целом), 2)потенциальную энергию взаимодействия молекул между собой, 3)кинетическую и потенциальную энергию колебательного движения атомов в молекуле, 4)энергию связи электронов с ядром в атоме, 5)энергию взаимодействия протонов и нейтронов внутри ядра атома. Эти энергии по величине очень сильно отличаются друг от друга, например, энергия теплового движения молекул при 300 К 0,04 эВ, энергия связи электрона в атоме 20-50 эВ, а энергия взаимодействия нуклонов в ядре 10 МэВ. Поэтому эти взаимодействия рассматривают по отдельности.
Внутренняя энергия идеального газа – это кинетическая энергия теплового движения его молекул. Она зависит только от температуры газа. Ее изменение имеет одинаковое выражение для любых процессов в идеальных газах и зависит только от начальной и конечной температур газа.
|
|
 нутренняя
энергия идеального газа
нутренняя
энергия идеального газа
изменение внутренней энергии идеального газа
Часто используют слова «тепловая энергия», «запас теплоты» при этом имеют в виду внутреннюю энергию, запас внутренней энергии.
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Первое начало термодинамики получено на основании множества опытных данных – по сути это закон сохранения энергии с учетом тепловых явлений. Оно имеет несколько формулировок.
1 |
«Теплота Q, сообщаемая системе идет на увеличение внутренней энергии dU системы и на работу A, совершаемую системой против внешних сил» |
|
2 |
«Изменение внутренней энергии dU системы происходит только за счет сообщения ей теплоты и (или) совершения над ней работы внешними силами»(А = А) |
|
3 |
«Невозможно построить вечный двигатель первого рода, т.е. такой периодически действующий двигатель, который совершал бы работу бóльшую, чем затраченная теплота» |
если система возвращается в исходное состояние, dU = 0 и A= Q |
Первое начало термодинамики «разрешает» построение такой тепловой машины, которая переводила бы всю затраченную теплоту в работу. Такая машина получила название вечного двигателя второго рода. Но согласно второму началу термодинамики создание такой машины невозможно. Иначе говоря, в любой тепловой машине всегда получается работы меньше, чем затрачивается энергии, часть затраченной энергии рассеивается в окружающей среде.
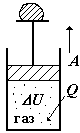 Рассмотрим первое
начало термодинамики в применении к
изопроцессам и адиабатическому процессу
для идеальных газов.
Рассмотрим первое
начало термодинамики в применении к
изопроцессам и адиабатическому процессу
для идеальных газов.
При этом удобно представлять себе тепловую машину в виде цилиндра с поршнем (трение пренебрежимо мало), на котором находится груз. При нагревании газ расширяется и «поднимает» груз, т.е. совершает работу против внешних сил - силы тяжести груза и силы атмосферного давления.
процесс |
I начало термодинамики |
|
изохорический |
|
теплота идет только на увеличение внутренней энергии газа (dV=0, A=0) |
|
|
теплота идет на увеличение внутренней энергии газа и на работу газа против внешних сил |
изотермический |
|
внутренняя энергия газа не меняется, а вся теплота идет на работу газа против внешних сил (dT=0, dU=0) |
адиабатический |
|
в адиабатическом процесса (происходящем без теплообмена с внешней средой) система может совершить работу только за счет убыли ее внутренней энергии |
Теперь рассмотрим каждый процесс в отдельности и выясним, какие полезные сведения можно получить при применении I начала термодинамики.
Изохорический процесс. Его можно осуществить, нагревая газ при закрепленном поршне. Подставим выражения для dQ и dU (формулы и рис. см. выше).
;
|
после сокращений получим выражение для теплоемкости СV |
|
|
|
молярная теплоемкость идеального газа при постоянном объеме она не зависит от температуры и определяется только числом степеней свободы молекул |
||
Изобарический процесс. Нагреваем газ при свободном ходе поршня – поршень будет перемещаться, когда давление внутри превышает давление извне (а оно постоянно). Если эти давления сравняются, поршень остановится.
|
подставим dQ, dU и А в I начало и после сокращений получим Ср |
|
|
молярная теплоемкость идеального газа при постоянном давлении – не зависит от температуры |
|
|
связь между молярными теплоемкостями, Ср СV потому, что при теплота идет не только на увеличение внутренней энергии, но и на работу против внешних сил |
Изотермический процесс. Представим себе, что цилиндр с поршнем помещен в очень большой сосуд с жидкостью. Вначале температура Т у жидкости и газа одинакова. Будем очень медленно поднимать поршень. Газ расширится, его температура уменьшится на dT, и теплота от жидкости перейдет к газу. При этом температура жидкости практически не изменится, т.к. у нее очень большой запас внутренней энергии. Перемещая бесконечно медленно поршень, мы в результате нагреем газ при постоянной температуре. Опуская поршень, мы таким же образом можем охладить газ. Естественно, такой процесс реально не осуществим, это идеализация, но она важна при теоретическом рассмотрении процессов в газах.
|
теплоемкость газа при становится бесконечно большой, т.е. все тепло, подводимое к газу «перерабатывается» им и переводится в работу |
Адиабатический процесс – это процесс, происходящий без теплообмена с окружающей средой. Его можно практически осуществить двумя способами:
1)теплоизолировать цилиндр – лучший теплоизолятор – вакуум, и перемещать поршень или 2) очень быстро переместить поршень, так чтобы теплообмен с окружающей средой не успел осуществиться (теплообмен – медленный процесс при не очень больших Т).
|
из I начала термодинамики; чтобы проинтегрировать это уравнение, надо «избавиться» от одной из переменных p,V, T. |
|
найдем dT, продифференцировав уравнение Менделеева-Клапейрона и подставим в |
|
сокращая и учитывая, что , получим дифференциальное уравнение с двумя переменными p и V |
|
разделим переменные, обозначим = Ср / СV и проинтегрируем; lnС – константа интегрирования |
Таким образом, на основе I начала термодинамики мы получили уравнение адиабатического процесса. Так как при таком процессе изменяются все три параметра p,V,T, то для адиабаты можно записать три уравнения процесса:
|
уравнения адиабатического процесса. Для получения второго и третьего уравнений следует использовать уравнение Менделеева – Клапейрона |
|
|
|
|
показатель степени адиабаты или коэффициент Пуассона |
Работу, совершаемую при адиабатическом процессе можно найти, проинтегрировав уравнение I начала термодинамики: .
|
|
Пусть газ находится в некотором состоянии с
о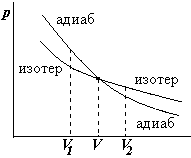 бъемом
V.
Зададимся вопросом, как выгоднее
бъемом
V.
Зададимся вопросом, как выгоднее
проводить расширение газа – адиабатически или
изотермически? Ответ – адиабатически (быстро
поднять поршень в цилиндре), т.к. площадь под
адиабатой меньше. А сжимать газ выгоднее
изотермически (очень медленно).
Теплоемкость газов.
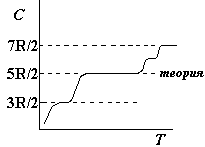 Из приведенных
выше формул следует, что теплоемкость
идеального газа не зависит от температуры
газа, а определяется только числом
степеней свободы молекул. Для многих
одноатомных и двухатомных газов опыт
подтверждает этот вывод для умеренных
температур. Но при низких и высоких
температурах наблюдается характерная
зависимость теплоемкости от температуры.
На графике приведена несколько
идеализированная зависимость молярной
теплоемкости от температуры для
двухатомного газа. Простейшее объяснение
такой зависимости состоит в следующем.
При низких температурах преобладает
поступательное движение молекул. С
ростом температуры все больше молекул
начинают участвовать во вращательном
движении. С дальнейшим повышением
температуры более интенсивно происходят
колебания атомов в молекулах. В
действительности объяснить зависимость
теплоемкости от температуры можно
только на основе квантовой механики.
Из приведенных
выше формул следует, что теплоемкость
идеального газа не зависит от температуры
газа, а определяется только числом
степеней свободы молекул. Для многих
одноатомных и двухатомных газов опыт
подтверждает этот вывод для умеренных
температур. Но при низких и высоких
температурах наблюдается характерная
зависимость теплоемкости от температуры.
На графике приведена несколько
идеализированная зависимость молярной
теплоемкости от температуры для
двухатомного газа. Простейшее объяснение
такой зависимости состоит в следующем.
При низких температурах преобладает
поступательное движение молекул. С
ростом температуры все больше молекул
начинают участвовать во вращательном
движении. С дальнейшим повышением
температуры более интенсивно происходят
колебания атомов в молекулах. В
действительности объяснить зависимость
теплоемкости от температуры можно
только на основе квантовой механики.