
- •10. Второй закон термодинамики. Функция состояния -энтропия. Расчет изменения энтропии при изобарном и изохорном процессах, при изотермическом расширении идеального газа, при смешении идеальных газов.
- •16. Влияние температуры на скорость реакции: уравнение Аррениуса. Энергия активации. Понятие об активированном комплексе. Методы расчета энергии активации.
- •17. Особенности кинетики гетерогенных химических реакций. Стадии процесса и области его протекания. Кинетика процесса в кинетической и диффузионных областях. Закон Фика.
- •18. Понятие о гомогенном катализе. Механизм действия катализатора. Энергетические диаграммы для некаталитической и каталитической реакции.
16. Влияние температуры на скорость реакции: уравнение Аррениуса. Энергия активации. Понятие об активированном комплексе. Методы расчета энергии активации.
Влияние
Т на скорость хим. реакций.
Основное влияние Т оказывает на константу
скорости. Вант-Гофф установил,
что при повышении Т на 10К скорость
реакции увеличивается в 2-4раза,
температурный коэффициент скорости
реакции Вант-Гоффа: 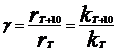 .
Правило было установлено для реакций,
протекающих в растворах при сравнительно
низких Т (0…120С). При повышении Т g
уменьшается и стремится к 1. Если известны
Т1 и скорость при ней:
.
Правило было установлено для реакций,
протекающих в растворах при сравнительно
низких Т (0…120С). При повышении Т g
уменьшается и стремится к 1. Если известны
Т1 и скорость при ней: ![]() . Уравнение
Аррениуса:
. Уравнение
Аррениуса: ![]() ,
Ea- аррениусовская или опытная Е активации,
k0-предэкс. множ-ль, мало зависящий от Т.
Можно представить в логарифмической
форме (для построения графика зав. lnk от
1/T). Ea можно вычислить по значениям
константы скорости, измеренным при
неск. разн. т-рах. Еа можно так же оценить,
если известны константы скорости при
2х Т, Т1 и Т2. Берем два логарифмических
Ур-ия (k1, k2, T1, T2), вычитаем и выражаем
Еа:
,
Ea- аррениусовская или опытная Е активации,
k0-предэкс. множ-ль, мало зависящий от Т.
Можно представить в логарифмической
форме (для построения графика зав. lnk от
1/T). Ea можно вычислить по значениям
константы скорости, измеренным при
неск. разн. т-рах. Еа можно так же оценить,
если известны константы скорости при
2х Т, Т1 и Т2. Берем два логарифмических
Ур-ия (k1, k2, T1, T2), вычитаем и выражаем
Еа: 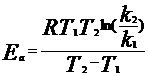 .
Еа
представляет собой избыток энергии (в
расчете на 1 моль) по сравнению со средней
Е молекул при данной Т, необходимый для
того, чтобы реагирующие частицы могли
вступить в хим. реакцию и определяется
св-вами реаг-х ч-ц, их Е состоянием.
Дифференциальное уравнение Аррениуса:
дифференцируем логарифмическое по Т,
откуда получаем, что чем больше Еа, тем
быстрее увеличивается k с возрастанием
Т.
Теория
активных столкновений:
реакция осуществляется в момент
столкновения 2х молекул А и В, столкновение
молекул приводит к хим. превращению
только в том случае, когда молекулы А и
В обладают достаточно большим запасом
Е. (она необходима для преодоления сил
отталкивания) Число 2-х соударений:
.
Еа
представляет собой избыток энергии (в
расчете на 1 моль) по сравнению со средней
Е молекул при данной Т, необходимый для
того, чтобы реагирующие частицы могли
вступить в хим. реакцию и определяется
св-вами реаг-х ч-ц, их Е состоянием.
Дифференциальное уравнение Аррениуса:
дифференцируем логарифмическое по Т,
откуда получаем, что чем больше Еа, тем
быстрее увеличивается k с возрастанием
Т.
Теория
активных столкновений:
реакция осуществляется в момент
столкновения 2х молекул А и В, столкновение
молекул приводит к хим. превращению
только в том случае, когда молекулы А и
В обладают достаточно большим запасом
Е. (она необходима для преодоления сил
отталкивания) Число 2-х соударений: 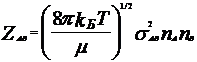 ,
, ![]() -
приведенная масса молекул, sАВ=(sА+sВ)/2,
sA, sB – диаметры молекул, nA, nB – число
соотв. молекул в ед. объема. Константа
скорости реакции второго порядка:
-
приведенная масса молекул, sАВ=(sА+sВ)/2,
sA, sB – диаметры молекул, nA, nB – число
соотв. молекул в ед. объема. Константа
скорости реакции второго порядка: 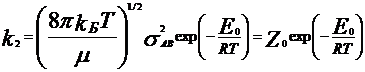 ,
Ео- истинная Еа. Там всякие преобразования,В
итоге связб Еа и Ео: Еа=Ео+1/2RT. Различие
между этими Е мало…
Теория
активированного комплекса.
В
ТАК для любой элем. р-ции предполагается,
что начальная конфигурация атомов
переходит в конечную в результате
непрерывного изменения межъядерных
расстояний. Например, в ходе элем. р-ции:
А+ВС->АВ+С сближаются атомы А и В, поэтому
расстояния Rab уменьшается, Rbc увеличивается.
В соотв. с этой теорией на 1 этапе строят
поверхность пот. энергии системы.
Установлено, что подобн. реак. осущ. с
наим. затр. Е, если атомы расп. на лин.,
соед. их центры. В проц. непр. изменения
межъяд. расст. всегда образуется промеж-я
конфиг. А…В…С, в кот. связь В-С уже
ослаблена, но еще полностью не разорвана,
а связь А-В уже начала образовыватся.
такая конфигурация является критической
для данной реакции. Продукты реакции
могут появиться только при условии
обр-я этой конфигурации, кот. наз.
переходным состоянием или активированным
комплексом. Кин. схема для элем. р-ции
имеет вид:
,
Ео- истинная Еа. Там всякие преобразования,В
итоге связб Еа и Ео: Еа=Ео+1/2RT. Различие
между этими Е мало…
Теория
активированного комплекса.
В
ТАК для любой элем. р-ции предполагается,
что начальная конфигурация атомов
переходит в конечную в результате
непрерывного изменения межъядерных
расстояний. Например, в ходе элем. р-ции:
А+ВС->АВ+С сближаются атомы А и В, поэтому
расстояния Rab уменьшается, Rbc увеличивается.
В соотв. с этой теорией на 1 этапе строят
поверхность пот. энергии системы.
Установлено, что подобн. реак. осущ. с
наим. затр. Е, если атомы расп. на лин.,
соед. их центры. В проц. непр. изменения
межъяд. расст. всегда образуется промеж-я
конфиг. А…В…С, в кот. связь В-С уже
ослаблена, но еще полностью не разорвана,
а связь А-В уже начала образовыватся.
такая конфигурация является критической
для данной реакции. Продукты реакции
могут появиться только при условии
обр-я этой конфигурации, кот. наз.
переходным состоянием или активированным
комплексом. Кин. схема для элем. р-ции
имеет вид: ![]() .
ОСНОВНОЙ постулат теории АК: исходные
в-ва всегда находятся в равновесии с
АК.
Константа скорости р-ции:
,
c- трансмиссионный коэффициент (учитывает
вероятность перехода АК в продукты
р-ции). Константа
равновесия:
.
ОСНОВНОЙ постулат теории АК: исходные
в-ва всегда находятся в равновесии с
АК.
Константа скорости р-ции:
,
c- трансмиссионный коэффициент (учитывает
вероятность перехода АК в продукты
р-ции). Константа
равновесия: ![]() . Уравнение
Эйринга:
. Уравнение
Эйринга: ![]() …
(энтропия и энтальпия активации). Это
Ур-ие справедливо для мономолек. р-ций
в газовой фазе и растворах.
…
(энтропия и энтальпия активации). Это
Ур-ие справедливо для мономолек. р-ций
в газовой фазе и растворах.
Основное влияние оказывает температура на константу скорости. Опираясь на опытные данные, Вант-Гофф установил, что при повышении температуры на 10 К скорость реакции увеличивается в 2-4 раза. Более точную зависимость константы скорости реакции от температуры устанавливает уравнение Аррениуса: k = k0 exр (- Еа \RT), где Еа- аррениусовская или опытная энергия активации; Т – абсолютная температура; R – универсальная газовая постоянная; k0 – предэкспоненциальный множитель, мало зависящий от температуры. уравнение Аррениуса часто представляют в логарифмической форме: lnk = lnk0 – Е0\RT удобной для графического определения энергии активации. Энергию активации (энтальпию активации) можно вычислить по значениям константы скорости, измеренным при нескольких разных температурах. По экспериментальным данным строят график зависимости lnk от1 \T тангенс угла наклона полученной прямой линии к оси Х равен (-Еа\R) стр 257 Энергию активации можно также оценить, если известны константы скорости при двух температурах Т1и Т2. Тогда для каждой температуры можно записать lnk1 = lnk0 – Е0\RT1 lnk2= lnk0 – Е0\RT2 вычитая из второго уравнения первое, получают: lnk2 – lnk1 = (lnk0 – Е0\RT2) – (lnk0 – Е0\RT1) отсюда: ln(k2\k1)= Еа (Т2–T1)\RТ2Т1 выражение для энергии активации имеет вид: Еа = RТ2Т1 ln(k2\k1)\(Т2–T1) где Еа - Дж\ моль Энергия активации представляет собой избыток энергии (в расчете на 1 моль) по сравнению со средней энергией молекул при данной температуре, необходимый для того, чтобы реагирующие частицы могли вступить в химическую реакцию и определяется свойствами реагирующих частиц, их энергетическим состоянием. Чтобы написать уравнение Аррениуса в дифференциальной форме, дифференцируют логарифмическую форму по температурах и получают: d lnk\dТ = Еа\RТ2 чем больше энергия активации, тем быстрее увеличивается константа скорости реакции с возрастанием температуры. В настоящее время разработаны две основные теории, объясняющие кинетику протекания элементарных реакций. Теория активных столкновений. Эта теория базируется на двух общих положениях.: -реакция осуществляется в момент столкновения двух молекул А и В; -столкновение приводит к химическому превращению только в том случае, когда молекулы А и В обладают достаточно большим запасом энергии. Эта энергия необходима для преодоления сил отталкивания, проявляющихся при сближении любых валентно-насыщенных молекул. Если относительная скорость движения молекул А и В (вдоль линии, соединяющей центры) достаточно велика, молекулы могут сблизится до таких малых расстояний, на которых возможно перераспределение химических связей в реагентах. В теории активированного комплекса для любой элементарной реакции предполагается, что начальная конфигурация атомов переходит в конечную в результате непрерывного изменения межъядерных расстояний. Например в ходе элементарной реакции А + ВС -> АВ + С сближаются атомы А и В. Расстояние А-В (R1) уменьшается, а расстояние В-С (R2) увеличивается. Установлено, что подобные реакции осуществляются с наименьшей затратой энергии, если атомы располагаются на одной линии, соединяющей их центры. Тогда ход реакции можно описать, использую всего два межъядерных расстояния R1 и R2. В процессе непрерывного изменения межъядерных расстояний всегда образуется промежуточная конфигурация А...В...С, в которой связь В-С уже ослаблена, но еще не полностью разорвана, а связь А-В уже начала образовываться. Такая конфигурация является критической для данной реакции. Продукты реакции могут появиться только при условии образования этой конфигурации, которая называется переходным состоянием или активированным комплексом.
