
- •Электрохимия
- •5.1. Ионика
- •5.1.1. Теория электролитической диссоциации Аррениуса
- •Диссоциация воды
- •Недостатки теории Аррениуса
- •5.1.2.Термодинамические свойства сильных электролитов
- •Теория сильных электролитов. Закон Дебая-Гюккеля
- •5.1.3. Неравновесные явления в растворах электролитов
- •5.2. Электродика
- •5.2.1. Основные понятия в электродике
- •Электродный потенциал
- •5.2.2. Зависимость электродного потенциала от концентрации потенциал определяющих ионов. Уравнение Нернста
- •5.2.3. Классификация электродов.
- •Окислительно-восстановительные электроды.
- •И электродным потенциалом
- •Ионоселективные электроды
- •5.2.4. Классификация электрохимических цепей.
- •Контрольные вопросы
Диссоциация воды
H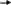
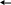 2O
H+ + OH-
2O
H+ + OH-
Равновесие определяется константой диссоциации
![]()
Степень диссоциации
воды очень мала, поэтому [H2O]
можно считать постоянной и равной
![]() ,
тогда
,
тогда
Кдис.[H2O]=[H+][OH-]
Правая часть уравнения представляет собой ионное произведение воды, левая обозначается Kw.
Kw = Кдис.[H2O].
Откуда следует, что Kw зависит от температуры также, как и Кдис. При 25 0С Kw= 1,008·10-14 ≈ 10-14.
В нейтральном растворе [H+] = [OH-] = 10-7. Такими величинами пользоваться неудобно и Сёренсен предложил использовать логарифмическую форму уравнения, умножив затем обе части на (-1):
lgKw = lg[H+] + lg[OH-] = -14,
-lgKw = -lg[H+] - lg[OH-] = 14 (при 25 0С),
где pH = -lgCH+, pOH = -lgCOH-.
и
рКw = pH +pOH,
рКw зависит от температуры
-
t, 0C
Kw
pKw
0
0,11410-14
14,94
10
0,29210-14
14,53
18
0,57010-14
14,24
20
0,68110-14
14,17
25
1,00010-14
14
По теории Аррениуса [H+] = c; pH =-lg(c).
Для расчета воспользуемся выражением для Кдис.:
![]() .
.
Если Кдис.
10-5 и <<1, то
Кдис.
2с.
И, соответственно, с=![]() .
.
В кислой среде [H+]>[OH-] при 25 0С рН<7;
в щелочной среде [H+]<[OH-] при 25 0С рН>7;
в нейтральной среде [H+]=[OH-] при 25 0С рН=7.
Для щелочных сред pH=pKw – pOH, а при 25 0С pH = 14 – pOH.
Недостатки теории Аррениуса
Теория Аррениуса оказалась применимой не для всех электролитов. Электролиты разделили на 2 группы:
Слабыми называют электролиты, которые диссоциируют не полностью и для них процесс диссоциации обратим. Степень диссоциации меняется от 0 до 1. зависит от концентрации, а Кдис. не зависит.
Сильными называются электролиты, для которых процесс диссоциации не обратим, и такие электролиты диссоциируют полностью. Понятие Кдис. не применимо.
Теория не рассматривала причины электролитической диссоциации.
Кистяковский и Каблуков развили работы Аррениуса, заметив, что растворы электролитов образуются при растворении веществ с ионной кристаллической решеткой или с ковалентной полярной связью.
В 1-ом случае в узлах кристаллической решетки находятся ионы, имеющие «+» или «-» заряд. К ним притягиваются молекулы растворителя противоположно-заряженным концом (рис.5.2). Возникают силы ион-дипольного взаимодействия между ионами вещества и молекулами растворителя. Если энергия ион-дипольного взаимодействия оказывается соизмеримой с энергией ион-ионного взаимодействия в кристаллической решетке, то происходит распад кристалла с образованием гидратированных (в воде) или сольватированных (в других растворителях) ионов.

Рис.5.2. Механизм электролитической диссоциации.
Расчеты показали, что при взаимодействии иона с диполем растворителя происходит значительное выделение энергии (теплота сольватации или гидратации), соизмеримое с энергией разрушения кристаллической решетки. Именно поэтому ионные системы устойчивы в растворе.
Во 2-м случае соединения с ковалентной полярной связью распадаются на ионы в полярных растворителях за счет диполь-дипольного взаимодействия молекул вещества и растворителя:
HClг + H2OH3O+ + Cl-.
Теория не учитывала электростатического взаимодействия между ионами в растворе. В электролитах, где велика и с значительна, электростатическое взаимодействие существенно отражается на их свойствах, для описания которых была создана теория сильных электролитов.
