
- •Углеводороды
- •Предельные (насыщенные) углеводороды
- •Непредельные углеводороды
- •Алканы (парафины)
- •Строение молекулы метана
- •Изомерия
- •Конформационная изомерия этана
- •Конформационная изомерия бутана
- •Получение
- •Физические свойства
- •Химические свойства
- •Механизм реакции бромирования алканов
- •Применение
- •Циклоалканы (циклопарафины)
- •Изомерия
- •Циклобутан, циклопентан и их конформации
- •Циклогексан и его конформации
- •Получение
- •Физические свойства
- •Химические свойства
- •Применение
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Электрофильное присоединение к алкенам
- •Реакция полимеризации
- •Радикальная полимеризация
- •Ионная или каталитическая полимеризация
- •Ионная полимеризация (катионная)
- •Ионная полимеризация (анионная)
- •Применение
- •Диеновые углеводороды (алкадиены)
- •Получение
- •Физические свойства
- •Химические свойства
- •Полимеризация диеновых соединений
- •Натуральный и синтетический каучуки
- •Ацетиленовые углеводороды (алкины)
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •I. Реакции присоединения
- •II. Кислотные свойства
- •Ароматические углеводороды (арены)
- •Строение бензола
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Электрофильное замещение в бензоле
- •Правила ориентации в бензольном ядре
- •Применение
- •Кислородсодержащие соединения
- •Спирты и фенолы
- •Физические свойства
- •Одноатомные спирты
- •Получение
- •Химические свойства
- •I. Реакции с разрывом связи ro–h
- •II. Реакции с разрывом связи r–oh.
- •III. Реакции окисления
- •IV. Дегидратация
- •Применение
- •Получение
- •Химические свойства
- •Применение
- • Жиры карбоновые кислоты
- •Получение
- •Химические свойства
- •Применение
- • Карбоновые кислоты жиры
- •Физические свойства
- •Химические свойства
- •Карбонильные соединения альдегиды и кетоны
- •Альдегиды
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Применение
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Применение
- •Номенклатура
- •Изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Пептиды. Белки
- •Химические свойства
- •Моносахариды
- •Углеводы. Генетический d- ряд сахаров
- •Генетический d- ряд сахаров
- •Построение формул Хеуорса для d- галактозы
- •Получение
- •Физические свойства
- •Химические свойства
- •I. Реакции по карбонильной группе
- •II. Реакции по гидроксильным группам
- •III. Специфические реакции
- •Дисахариды
- •Полисахариды
- •Крахмал
- •Целлюлоза (клетчатка)
II. Реакции с разрывом связи r–oh.
1. С галогеноводородами:
R–OH + HBr R–Br + H2O
2. С концентрированной серной кислотой:
C2H5O- |
-H + H–O |
|
O |
|
C2H5O |
O |
|
|
\ // S / \\ |
|
|
|
\ // S (этилсерная кислота) + H2O / \\ |
|
H–O |
|
O |
|
H–O |
O |
|
C2H5–O |
|
O |
|
C2H5O |
O |
|
|
\ // S / \\ |
|
|
|
\ // S (диэтилсерная кислота(диэтилсульфат)) + H2O / \\ |
C2H5O- |
-H + H–O |
|
O |
|
C2H5O |
O |
III. Реакции окисления
1. Спирты горят:
2С3H7ОH + 9O2 6СO2 + 8H2O
2. При действии окислителей:
a) первичные спирты превращаются в альдегиды (или в карбоновые кислоты)
|
|
|
|
O II |
|
|
O II |
|
R- |
-CH2–OH |
(первичный спирт) ––[O] |
R- |
-C |
(альдегид) ––[O] |
R- |
-C |
(карбоновая к-та) |
|
|
|
|
I H |
|
|
I OH |
|
|
K2Cr2O7 |
O II |
K2Cr2O7 |
O II |
CH3–CH2–OH |
–––– |
CH3–C |
–––– |
CH3–C |
|
H2SO4 |
I H |
H2SO4 |
I OH |
O II CH3OH + CuO ––t H–C I H |
+ Cu + H2O |
b) вторичные спирты окисляются до кетонов
R- |
-CH- |
-R’(вторичный спирт) ––[O] |
R- |
-C- |
-R'(кетон) |
|
I OH |
|
|
II O |
|
CH3– |
CH–CH2–CH3 I OH |
––K2Cr2O7,H2SO4 |
CH3– |
C–CH2–CH3 II O |
c) третичные спирты устойчивы к действию окислителей.
IV. Дегидратация
Протекает при нагревании с водоотнимающими реагентами.
1. Внутримолекулярная дегидратация приводит к образованию алкенов
CH3–CH2–OH ––t>140C,H2SO4 CH2=CH2 + H2O
CH3 \ |
|
|
|
CH3 I |
CH3–C– |
CH–CH3 |
––t,H2SO4 |
CH3– |
C=CH–CH3 + H2O |
I HO |
I H |
|
|
|
При отщеплении воды от молекул вторичных и третичных спиртов атом водорода отрывается от соседнего наименее гидрогенизированного атома углерода; образующийся алкен содержит наибольшее число заместителей при двойной связи (правило Зайцева).
2. Межмолекулярная дегидратация даёт простые эфиры
R- |
-OH + H- |
-O–R –– t,H2SO4 R–O–R(простой эфир) + H2O |
CH3–CH2- |
-OH + H- |
-O–CH2–CH3 ––t<140C,H2SO4 CH3–CH2–O–CH2–CH3(диэтиловый эфир) + H2O |
Обе реакции конкурируют между собой. Увеличение температуры и разбавление инертным растворителем благоприятствуют внутримолекулярному процессу.
Многоатомные спирты
Получение
1. Этиленгликоль (этандиол-1,2) синтезируют из этилена различными способами:
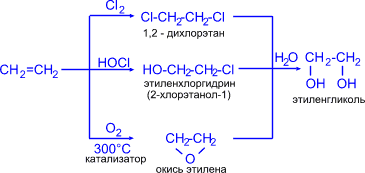
3CH2=CH2 + 2KMnO4 + 4H2O 3HO–CH2–CH2–OH + 2MnO2 + 2KOH
2. Глицерин (пропантриол -1,2,3) получают гидролизом жиров (см. "Жиры") или из пропилена по схемам:

Физические свойства
Этиленгликоль и глицерин – бесцветные, вязкие жидкости, хорошо растворимые в воде, имеют высокие температуры кипения.
Химические свойства
Для многоатомных спиртов характерны основные реакции одноатомных спиртов. В отличие от них, они могут образовывать производные по одной или по нескольким гидроксильным группам, в зависимости от условий проведения реакций.
Многоатомные спирты, как и одноатомные, проявляют свойства кислот при взаимодействии с активными металлами, при этом происходит последовательное замещение атомов водорода в гидроксильных группах.
CH2–OH I CH2–OH |
Na ––– -1/2H2 |
CH2–ONa I CH2–OH |
Na ––– -1/2H2 |
CH2–ONa I CH2–ONa |
Увеличение числа гидроксильных групп в молекуле приводит к усилению кислотных свойств многоатомных спиртов по сравнению с одноатомными.
Так, они способны растворять свежеосаждённый гидроксид меди (II) с образованием внутрикомплексных соединений:
CH2–OH 2 I + Cu(OH)2(голубой осадок) CH2–OH
|
|
(одноатомные спирты с Cu(OH)2 не реагируют).
Глицерин легко нитруется, давая тринитроглицерин – сильное взрывчатое вещество (основа динамита):
CH2–O- |
-H |
|
HO- |
-NO2 |
|
CH2–O–NO2 |
|
I |
|
|
|
|
H2SO4 |
I |
|
CH –O- |
-H |
+ |
HO- |
-NO2 |
––– |
CH–O–NO2 |
+ 3H2O |
I |
|
|
|
|
|
I |
|
CH2–O- |
-H |
|
HO- |
-NO2 |
|
CH2–O–NO2 |
|
При его взрыве выделяется большое количество газов и тепла:
CH2–O–NO2 I 4CH–O–NO2 12CO2 + 6N2 + 10H2O + O2 + Q I CH2–O–NO2 |

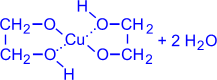 (гликолят
меди (ярко-синий раствор))
(гликолят
меди (ярко-синий раствор))