
- •1. Электродные процессы. Двойной электрический слой.
- •2. Гальванические элементы и цепи.
- •3. Электродные потенциалы. Водородный электрод. Ряд напряжений Ме.
- •4. Классификация электродов.
- •5.Стеклянный электрод.
- •6. Зависимость напряжений гэ от t - ры. Метод эдс.
- •9.Методы определения порядка реакции
- •13. Растворы электролитов. Теория электролитической диссоциации (I, a, Kg).
- •14. Сильные электролиты.
- •15. Механизм движения ионов. Абсолютная скорость ионов.
- •16(А). Удельная эл. Проводность р-ра.
- •16(Б). Эквивалентная проводность.
13. Растворы электролитов. Теория электролитической диссоциации (I, a, Kg).
Электрохимия делится на 2-а раздела:
1.Учение об электр-сти растворов электролитов. Изучаем св-ва веществ с ионным типом электр-сти. Р-ры и расплавы электролитов, а так же твёрдые соли.
2. Учение об электродных процессах. Изучает законом-сти прот-ния хим. р-ий под воздействием элект-кой энергии и наоборот.
Электролиты – в-ва, которые в р-ре или расплаве полностью или частично состоит из ионов (при раст-ии самопр-льно распадаются на ионы). Для р-ров электролитов создана теория электрлит. диссоциации. В основе теории лежит след. положения:
1.электрол. проводят эл. ток.
2.Отклонение св-ств электролитов от св-ств неэлектр.
Основные направления теории:
1.При растворении в р-ле, в Н2О, молекулы р-ля распад. на (-) и (+) заряженные ионы. Энергия взаимодействия р-ля с молекулой эл-та достаточна для разрыва ионной связи. Работа по разъединению ионов (сальвотация) сопр-тся уменьшением энергии Гиббса сис-мы.
2. Процесс диссоциации явл-ся обратимым и в р-ре эл-та существ. динамич-ое равновесие. Полная диссоциация осущ-тся с разбавлением р-ров.
С Н3СООН СН3СОО- +Н+
3.Суммарный (+) заряд ионов равен сум-му (-) заряду ионов.
4.Силы взаимодействия между ионами отсутствуют и р-ры электролитов ведут себя как идеальные газы. Это справедливо только для разбавленных р-ров электролитов.
Последний пункт является недостатком теории Аррениуса. Теория объясняет основные закономерности в поведении эл-ов. Для количества оценки процесса диссоциации Аррениус ввёл величину степени диссоциации.(a).
a = число продиссоц. молекул / число молекул, введ в р-р.
По степени диссоциации эл-ты делятся на сильные и слабые. Для слабых a << 1, для сильных a=.1
Сильные эл-ты диссоци-ся необратимо, слабые – обратимо. Из з-на действ. масс:
Кg = [CH3COO-][H+] / [CH3COOH]
K g – const диссоциация явл-ся характеристикой слабого эл-та при данной t-ре. Не зависит от концентрации р-ра. Степень диссоциации ув-ся с умен-ием концентрации. С 0, a 1

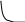
 С
С
Взаимосвязь степени и const дисс-ии установил закон разв-ия Оствальда.
[CH3COO-] = [H+] = aC0
[CH3COOH] =(1 - a)C0
C0 – исх. концентрация р-ра эл-та.
Kg = a2*C0 / 1 – a = h2 / (1 - a)*V
V = 1 / C
И
 ногда
для р-ров слабых электролитов можно
пренебреч знаменателем, тогда:
ногда
для р-ров слабых электролитов можно
пренебреч знаменателем, тогда:
K g
= a2
* C =>a
= K / C
g
= a2
* C =>a
= K / C
Для сильных элект-тов закон разведен. Оствальда не применим.
Р-ры электролитов (реальных) обнар. большие отклонения от идеальных растворов. Это обусловлено увеличение числа частиц в процессах диссоциации. Для учёта отклонения ввод изотонический коэф-ент(i).
i = св-во эл-та / св-во не эл-та = С эл-та / С не эл-та = DТ зам. эл-та / DТ зам. эл-та.
Изотонический коэф-нт – отношения фактического числа в р-ре к тому, которое было бы в отсутств. диссоциации. Опред. связь между изотоническим коэф-ми степенью диссоциации.
N – общее число малекул, введ. в р-р.
i = N[1 + (K - 1)a] / N
aN – число малекул, котор. продиссоциир-ы.
К – число ионов, кот. образ при диссоц.
(1 - a)N – число мал, кот, не продиссоц.
для описания св-ств реальных р-ров эл-тов необход. учитывать изотоническ. коэффициент.
Пнеэл. = СRT; Пэл = iCRT
