
4. Окислительно-восстановительные реакции
Окислительно-восстановительными называют реакции, идущие с изменением степени окисления атомов элементов, входящих в состав реагирующих веществ. Процесс окисления сопровождается отдачей электронов, процесс восстановления — присоединением электронов. В окислительно-восстановительных реакциях эти процессы протекают одновременно — одно вещество окисляется, другое восстанавливается. Вещества, присоединяющие электроны, называют окислителями, вещества, отдающие электроны,— восстановителями. Общее число электронов, отданное в процессе реакции восстановителем, должно быть равно числу электронов, присоединенных окислителем. На этом основаны два метода составления уравнений окислительно-восстановительных реакций: метод электронного баланса и ионно-электронный метод (полуреакций). Согласно методу электронного баланса подсчет числа отданных и присоединенных электронов ведется с учетом степени окисления атомов элементов. Ионно-электронный метод применим для реакций, протекающих в водном растворе, и основан на составлении отдельных ионных yравнений для процессов окисления и восстановления с последующим суммированием их в общее уравнение окислительно-восстановительной реакции. При этом учитывают правила написания ионных уравнений, т.е. сильные электролиты записывают в виде ионов, слабые электролиты и неэлектролиты, газы и труднорастворимые вещества — в виде молекул. Сумма электрических зарядов в левой части уравнения должна быть равна сумме электрических зарядов в правой части.
Пример 1(в примерах рассматриваются различные типы окислительно-восстановительных реакций). Расставьте коэффициенты в уравнении реакции:
H2S+O2SO2+H2O.
Р е ш е н и е. Определим степень окисления атомов элементов, у которых она в ходе реакции изменяется:
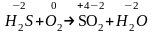
Напишем электронные уравнения, учитывая число атомов в молекулах:

Расставим коэффициенты в уравнении реакции:
2H2S+3O22SO2+2H2O
Пример 2. Расставьте коэффициенты в уравнении реакции:
Cu+HNO3(разб.)Cu(NO3)2+NO+H2O.
Р е ш е н и е. В данном случае HNO3 расходуется и в окислительно-восстановительном процессе (HNO3 окисляет медь, восстанавливаясь до NO), и в обменной реакции (HNO3 участвует в процессе солеобразования). Вначале найдем коэффициенты в окислительно-восстановительном процессе. Для этого определим степени окисления атомов элементов, изменяющих ее в ходе реакции:
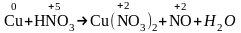 .
.
Напишем электронные уравнения:
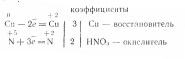
окисление
восстановление
Расставим коэффициенты в уравнении реакции:
3Cu+2HNO33Cu(NO3)2+2NO+H2O.
Учтем, что на образование нитрата меди, согласно приведенной схеме, потребуется 6 молекул азотной кислоты. Суммарный коэффициент перед формулой азотной кислоты равен 8:
3Cu+8HNO33Cu(NO3)2+2NO+4H2O.
Пример 3. Расставьте коэффициенты в уравнении реакции:
KMnO4+HClMnCl2+Cl2+KCl+H2O
Р е ш е н и е. Определим степень окисления атомов элементов:
 .
.
Напишем электронные уравнения:

восстановление
окисление
Следует учесть, что, если перед формулой соляной кислоты будет поставлен коэффициент 5, получается дробной число молекул Cl2. Поэтому коэффициенты, найденные из электронных уравнений, следует удвоить:

Схема уравнения реакции:
2KMnO4+10HCl2MnCl2+5Cl2+2KCl+H2O.
Учтя дополнительно число молекул соляной кислоты, которое расходуется на образование солей (6 молекул), составим окончательное уравнении реакции:
2KMnO4+16HCl=2MnCl2+5Cl2+2KCl+8H2O.
Пример 4. Расставьте коэффициенты в уравнении реакции:
FeS2+HNO3Fe(NO3)3+NO+H2SO4+H2O.
Решение. При подборе коэффициентов следует учитывать суммарное число отданных (или, в других реакциях, принятых) электронов атомами различных элементов, входящими в состав одного соединения. В дисульфиде железа, который можно рассматривать как соль кислоты Н—S—S—Н, степень окисления атомов серы —1, железа +2.
Определим степень окисления атомов остальных элементов:
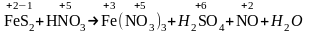 .
.
Напишем электронные уравнения:
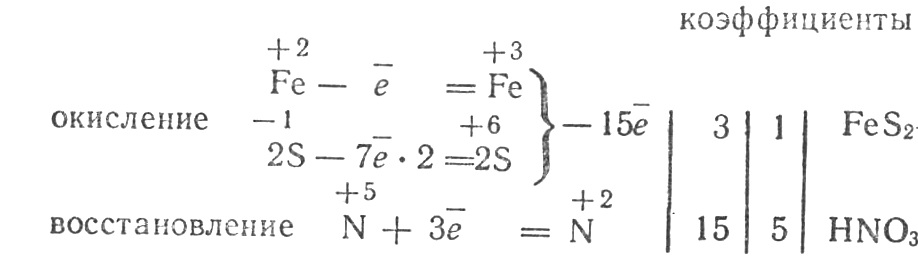
- восстановитель
- окислитель
Схема уравнения реакции:
FeS2+5HNO3Fe(NO3)3+5NO+2H2SO4+H2O.
С учетом того, что 3 молекулы азотной кислоты расходуются на образование нитрата, составим окончательное уравнение реакции:
FeS2+8HNO3=Fe(NO3)3+5NO+2H2SO4+2H2O.
Пример 5. Расставьте коэффициенты в уравнении реакции:
KClO3KCl+O2.
Р е ш е н и е. Учитывая, что процесс внутримолекулярного окисления-восстановления и переход электронов от окислителя к восстановителю происходит между атомами различных элементов одного и того же вещества, коэффициенты подбираются в соответствии с ранее сформулированными правилами, но расчет ведется по схеме слева направо.
Определим степень окисления атомов элементов:
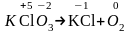 .
.
Напишем электронные уравнения:
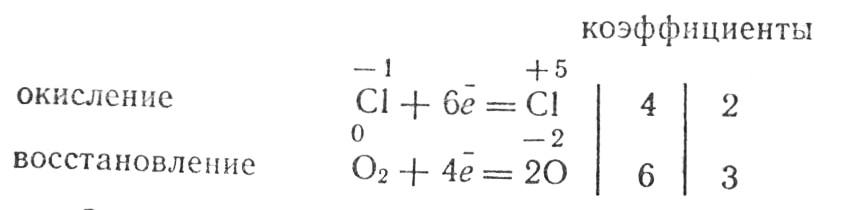
Эти коэффициенты расставим в правой части уравнения перед формулами KCl и O2, после чего подберем коэффициент в левой части уравнения:
2KClO3=2KCl+3O2.
Пример 6. Расставьте коэффициенты в уравнении реакции:
Cl2+KOHKCl+KClO3+H2O.
Р е ш е н и е. В данном случае в роли окислителя и восстановителя выступают атомы одного и того же элемента, входящие состав одного вещества. Реакции такого типа называют реакциями диспропорционирования.
Степень окисления изменяют атомы хлора:
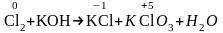 .
.
Подбор коэффициентов ведется по обычным правилам, но справа налево.
Н апишем
электронные уравнения:
апишем
электронные уравнения:
окисление
восстановление
Расставим коэффициенты, начиная с правой части уравнения:
Cl2+KOH5KCl+KClO3+H2O;
3Cl2+6KOH=5KCl+KClO3+3H2O.
Пример 7. Используя ионно-электронный метод, расставьте коэффициенты в уравнении реакции:
Zn+HNO3Zn(NO3)2+NH4NO3+H2O.
Р е ш е н и е. Напишем схему ионного уравнения реакции:
Zn+H++NO3¯Zn2++NH4+ +H2O
и схемы уравнений полуреакций окисления и восстановления:
окисление ZnZn2+
восстановление NO3¯NH4+
Из двух последних схем следует, что для баланса числа атомов и зарядов в первом случае в левой части уравнения надо вычесть 2 электрона; во втором — в левую часть уравнения включить 10 ионов Н+ для связывания из иона NO3¯ трех атомов кислорода (образуется ЗН2О) и одного атома азота (образуется NH4+) и в эту же левую часть уравнения включить 8 электронов.
Напишем уравнения полуреакций окисления и восстановления:
окисление
Zn
– 2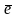 =Zn2+
=Zn2+
восстановление NO3¯+10H++8 =NH4+3H2O.
Учтя, что число отданных и принятых электронов должно быть одинаковым, найдем коэффициенты:
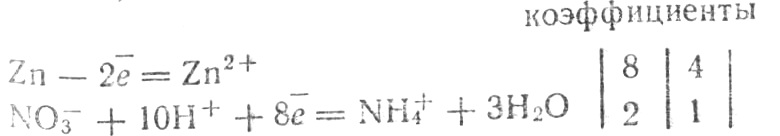
Суммируя, получим:
 .
.
После приведения подобных членов получим:
 .
.
Правильность составления уравнения проверяется по балансу числа атомов и зарядов в левой и правой частях уравнения. Уравнение реакции в молекулярной форме:
4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O.
4-1. Какие из реакций, уравнения которых приведены ниже, являются окислительно-восстановительными:
а) СаО + СО2 = СаСО3;
б) Sn + O2 = SnO2;
в) 4Р + 5O2 = 2Р2O5;
г) Fe + H2SO4 = FeSO4 + Н2;
д) HNO3 + КОН = KNO3 + Н2O;
е) CO2 + 2NaOH = Na2CO3 + H2O?
4-2. Возможно ли, чтобы одно и то же вещество в одних реакциях выступало в роли окислителя, в других — восстановителя? Если это так, приведите примеры.
4-3. Какие свойства — восстановителя или окислителя – проявляет водород в следующих реакциях:
а) Н2 + С12 = 2НС1; в) 2Н2 + O2 = 2Н2O;
б) Н2 + Са = СаН2; г) Н2 + 2Li = 2LiH?
4-4. Какой процесс — окисления или восстановления — происходит, когда: а) нейтральные атомы превращаются в положительно заряженные ионы; б) нейтральные атомы превращаются в отрицательно заряженные ионы; в) положительный заряд иона увеличивается; г) положительный заряд иона уменьшается; д) отрицательный заряд иона уменьшается?
4-5. Вместо пропусков вставьте нужные слова а) атомы элемента окислителя ... электроны, сами при этом ...; б) атомы элемента восстановителя ... электроны, сами при этом ... .
4-6. Какие из приведенных ниже электронных уравнений характеризуют процессы окисления, какие — восстановления:
а)
Cu2++2 =Cu;
г)
S
+ 2
= S2¯;
=Cu;
г)
S
+ 2
= S2¯;
б)
Fe2+
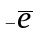 =Fe3+;
д)
=Fe3+;
д)
 ;
;
в) Fe – 2 =Fe2+; е) S+4 =S?
4-7. Закончите электронные уравнения:
а)
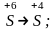 в) 2Cl-1Cl2;
д)
в) 2Cl-1Cl2;
д)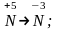
б)
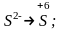 г)
г)
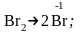 е)
е)
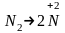 .
.
4-8. Напишите уравнения реакций взаимодействия с кислородом: а) алюминия; б) молибдена; в) кремния. Составьте электронные уравнения процессов окисления и восстановления. Укажите окислители и восстановители.
4-9. Напишите уравнения реакций взаимодействия с водородом оксидов: а) кобальта (II); б) железа (II); в) меди (I). Составьте электронные уравнения процессов окисления и восстановления. Укажите окислители и восстановители.
*4-10. Какие из веществ — кислород, хлор, водород, алюминий — могут быть использованы для: а) превращения цинка по схеме Zn Zn2+; б) превращения меди и железа по схемам СuОСu, Fe2O3Fe?
*4-11. С учетом степени окисления атомов элементов в приведенных ниже соединениях и степеней окисления, характерных для этих элементов вообще (от —3 до +5 для N, от 0 до +6 для Сr, от —2 до +6 для S, от 0 до +7 для Мn, от — 1 до +7 для Вr и I) сделайте вывод о возможности или невозможности окислительно-восстановительных реакций между веществами: а) НNО3 и К2Сr2O7; б) КМnO4 и SO2; в) H2SO3 и Br2; г) HNO3 и H2S; д) КМnO4 и HI; е) H2SO4 и H2S.
4-12. Используя метод электронного баланса, расставьте коэффициенты в следующих уравнениях реакций:
а) H2S + O2S + H2O;
б) NH3 + O2 N2 + H2O;
в) S + HNO3H2SO4 + NO;
г) H2S + C12S + HC1;
д) Fe (NO3)2 + ZnZn (NO3)2 + Fe;
е) С + H2SO4 (конц.)СO2+ SO2 + H2O;
ж) HI + H2SO4 (конц.) I2+ H2S + H2O;
з) Fe2O3 + C Fe + CO2;
и) HCl + КСlO3C12+KCl + H2O;
к) H2SO3 + H2SS + H2O.
4-13. Расставьте коэффициенты в следующих уравнениях реакций:
а) Na2SO3+KMnO4+H2SO4Na2SO4+K2SO4+MnSO4+H2O;
б) KNO2+KMnO4+H2SO4KNO3+K2SO4+MnSO4+H2O;
в) Na2S+KMnO4+H2SO4S+Na2SO4+K2SO4+MnSO4+H2O;
г) NaBr+K2Cr2O7+H2SO4Br2+Na2SO4+K2SO4+Cr2(SO4)3+H2O;
д) H2S+ K2Cr2O7+H2SO4 S+K2SO4+ Cr2(SO4)3+H2O;
е) MnO2+KNO3+KOHK2MnO4+KNO2+H2O;
ж) Cr2O3+KClO3+KOHK2CrO4+KCl+H2O;
з) Cr2(SO4)3+Cl2+NaOHNa2CrO4+NaCl+Na2SO4+H2O;
и) Fe(OH)2+O2+H2OFe(OH)3.
4-14. Используя ионно-электронный метод, расставьте коэффициенты в следующих уравнениях реакций:
а) Ni+HNO3Ni(NO3)2+NO+H2O;
б) K2Cr2O7+K2SO3+H2SO4K2SO4+Cr2(SO4)3+H2O;
в) CrCl3+Cl2+NaOHNa2CrO4+NaCl+H2O;
г) NaI+KMnO4+H2SO4I2+Na2SO4+MnSO4+H2O+K2SO4;
д) NaBr+NaBrO3+H2SO4Br2+Na2SO4+H2O.
4-15. Напишите в ионной форме следующие уравнения окислительно-восстановительных реакций и расставьте коэффициенты:
а) Al+H2SO4(разб.)Al2(SO4)3+H2;
б) Na2S+Cl2+H2ONa2SO4+HCl;
в) S+Br2+NaOHNa2SO4+NaBr+H2O;
г) KClO+K2SKCl+K2SO4.
