
Сборник задач по химии
Растворы
Растворимость веществ в воде
Раствор, в котором данное вещество при данной температуре больше не растворяется, называется насыщенным. Раствор, в котором данное вещество при данной температуре ещё может растворяться, называется ненасыщенным. Раствор с большим содержанием растворённого в нём вещества называется концентрированным, с малым – разбавленным.
Растворимостью, или коэффициентом растворимости, называется отношение массы вещества, образующего насыщенный раствор при данной температуре, к объёму растворителя. Растворимость выражается в г/л, а также в граммах вещества, которое может содержаться в 100 г насыщенного раствора.
Растворимость зависит от природы растворяемого вещества и растворителя, температуры и давления (в случае растворения газообразных веществ). С повышением температуры растворимость в воде большинства твёрдых веществ повышается, газов – понижается. Растворимость газов прямо пропорциональна давлению.
Пример 1. Сколько фосфата натрия (в г) необходимо растворить в 0,25 л воды для приготовления насыщенного при 40 °С раствора, если растворимость соли при указанной температуре равна 223 г/л?
Р е ш е н и е. Учитывая растворимость соли, составляем соотношение:
в 1 л воды растворяется 223 г Na3PO4
в 0,25 л воды растворяется x г Na3PO4
Откуда
 ,
,
 (г).
(г).
Пример 2. Какой объём воды необходимо взять для растворения 178,4 г хлорида бария, чтобы приготовить насыщенный при 20 °С раствор? Растворимость соли при этой температуре равна 357 г/л.
Р е ш е н и е. Учитывая растворимость соли, составляем соотношение:
в 1 л воды растворяется 357 г BaCl2
в x л воды растворяется 178,4 г BaCl2
Откуда

 (л).
(л).
Пример 3. Какова растворимость нитрата калия при 25 °С, если в 300 г насыщенного при этой температуре раствора 82,45 г соли?
Р е ш е н и е. Вычислим, сколько соли (в г) растворяется в 1 л воды. По условию задачи 82,45 г соли растворено в 217,55 г (300 – 82,45), или 0,217 л, (ρ=1 г/см3) воды. Следовательно,
в 0,217 л воды растворяется 82,45 г KNO3
в 1 л воды растворяется x г KNO3
Откуда

 (г).
(г).
Пример 4. Растворимость хлорида калия при 20 °С равна 344 г/л. Вычислите массу хлорида калия, содержащегося в 400 г насыщенного при этой температуре раствора.
Р е ш е н и е. Учитывая, что масса раствора, в котором содержится 344 г хлорида калия, равна 1344 г (1000+344), вычислим, сколько KCl содержится в 400 г такого раствора:
в 1344 г раствора содержится 344 г KCl
в 400 г раствора содержится x г KCl
Откуда
 ,
,
 (г)
(г)
Пример 5. Сколько сульфата лития и воды (в г) необходимо взять для приготовления 600 г насыщенного при 30 °С раствора? Растворимость соли при этой температуре равна 341 г/л.
Р е ш е н и е. Найдём, сколько сульфата лития (в г) необходимо взять для приготовления 600 г раствора, учитывая, что масса насыщенного при 30 °С раствора сульфата лития в расчёте на 1000 г воды равна 1341 г (1000+341)
В 1341 г раствора содержится 341 г Na2SO4
В 600 г раствора содержится x г Na2SO4
Откуда
 ,
,
 (г).
(г).
Масса воды равна 600 – 152,57 = 447,43 (г).
Пример 6. Растворимость безводного карбоната натрия при 20 °С составляет 218 г/л. Какой минимальный объём воды необходимо взять, чтобы при 20 °С растворить 29,4 г кристаллической соды?
Р е ш е н и е. Учитывая, что молярные массы кристаллического и безводного карбоната натрия соответственно равны 286 и 106 г/моль, найдём, сколько карбоната натрия и воды содержится в 29,4 г кристаллогидрата.
В 286 г Na2CO3*10H2O содержится 106 г Na2CO3
В 29,4 г Na2CO3*10H2O содержится x г Na2CO3
Откуда

 10,9
(г).
10,9
(г).
Масса воды, содержащейся в кристаллогидрате, равна 29,4 – 10,9 = 18,5 (г), или 18,5 (мл). Зная растворимость карбоната натрия, вычислим, сколько воды потребуется для растворения 10,9 г Na2CO3 :
218 г Na2CO3 растворяется в 1 л H2O
10,9 г Na2CO3 растворяется в y л H2O
Откуда

 (л), или 50 мл.
(л), или 50 мл.
Вычислим объём воды, который необходимо взять для растворения соли: 50 мл – 18,5 мл = 31,5 мл.
Пример 7. Растворимость нитрата калия при 60 °С и 20 °С соответственно равна 1101 и 316 г/л. Сколько нитрата калия (в г) выделится из 40 г насыщенного при 60 °С раствора, если его охладить до 20 °С?
Р е ш е н и е. Учитывая, что масса насыщенного при 60 °С раствора в расчёте на 1000 г воды равна 2101 г (1000+1101), определим, сколько нитрата калия и воды содержится в 40 г такого раствора.
В 2101 г раствора содержится 1101 г KNO3
В 40 г раствора содержится x г KNO3
Откуда

 (г)
(г)
В 40 г раствора содержится 40 г – 20,96 г = 19,04 г воды. Вычислим, сколько KNO3 (в г) может раствориться при 20 °С в 19,04 г воды.
В 1000 г воды растворяется 316 г KNO3
В 19,04 г воды растворяется y г KNO3
Откуда
 (г).
(г).
При охлаждении раствора выделится 14,94 г (20,96 – 6,02) нитрата калия.
В один стакан чая положили кусок сахара, во второй – столько же мелкокристаллического сахара. В каком из стаканов сахар растворится быстрее (температура одинаковая)? Является ли различной растворимость сахара в этих двух случаях?
Два стакана с минеральной водой, прежде находившиеся в разных условиях, поместили в одинаковые. Через некоторое время на стенках одного из стаканов появились пузырьки газа. Что можно сказать об условиях, при которых вода в этом стакане находилась ранее?
При растворении в воде какого из веществ – твёрдого или газообразного – с повышением температуры резко уменьшается его растворимость?
Какие из перечисленных ниже факторов способны влиять на скорость растворения твёрдой соли в воде, какие – на растворимость соли: а) объём (масса) воды; б) степень измельчения твёрдой соли; в) интенсивность перемешивания раствора; г) температура; д) давление; е) природа соли?
Какие из перечисленных ниже факторов следует учитывать при объяснении того, что скорость процесса растворения твёрдого вещества с повышением температуры обычно увеличивается: а) повышение скорости движения молекул воды; б) повышение частоты соударений молекул воды с поверхностью твёрдого вещества; в) увеличение скорости движения частиц переходящего в раствор вещества; г) ускорение достижения равномерного распределения частиц растворённого вещества по всему объёму раствора; д) увеличение объёма раствора?
Какие из перечисленных ниже факторов влияют на растворимость газа в воде: а) температура; б) давление; в) скорость пропускания газа через воду; г) размеры пузырьков газа, проходящих через воду; д) возможность химического взаимодействия газа с водой?
 Насыщенные
при 50 °С растворы калийной селитры,
медного купороса и поваренной соли
охладили до 10 °С. Используя приведённый
на рисунке 12 график, определите, из
какого раствора при охлаждении выделится
наименьшее, из какого – наибольшее
количество осадка.
Насыщенные
при 50 °С растворы калийной селитры,
медного купороса и поваренной соли
охладили до 10 °С. Используя приведённый
на рисунке 12 график, определите, из
какого раствора при охлаждении выделится
наименьшее, из какого – наибольшее
количество осадка.В стаканы, содержащие насыщенные при 10 °С растворы йодида калия, медного купороса, хлорида аммония, добавили по 40 г каждого из этих веществ. Растворы нагрели до 50 °С. Используя рисунок 12, определите, в каком случае растворится больше вещества, в каком – меньше.
Возможно ли, чтобы раствор был одновременно: а) насыщенным и концентрированным; б) насыщенным и разбавленным; в) ненасыщенным и разбавленным; г) ненасыщенным и концентрированным?
Используя данные, приведённые в таблице, определите, какие из насыщенных растворов являются концентрированными, какие – разбавленными.
Формула вещества |
NaNO3 |
NaBr |
CaSO4 |
Ca(OH) 2 |
KNO3 |
AgNO3 |
Ag2SO4 |
HgBr2 |
Растворимость при 20 °С (г/л) |
876 |
908 |
2 |
1,6 |
316 |
2225 |
8 |
5,5 |
Вычислите массу нитрата натрия, который необходимо растворить в 400 г воды для приготовления насыщенного при 20 °С раствора. Растворимость соли при этой температуре 876 г/л.
Вычислите массу йодида калия, который необходимо растворить в 0,5 л воды для приготовления насыщенного при 10 °С раствора. Растворимость соли при этой температуре равна 1358 г/л.
Какой объём воды необходимо взять для растворения 28,8 г безводного сульфата натрия, чтобы приготовить насыщенный при 10 °С раствор? Растворимость соли при этой температуре равна 96 г/л.
Какой объём воды необходимо взять для растворения 788 г фосфата калия, чтобы приготовить насыщенный при 20 °С раствор? Растворимость соли при этой температуре равна 985 г/л.
Какова растворимость бромида меди (II) при 30 °С, если в 200 г насыщенного при этой температуре раствора содержится 112,2 г соли?
В фарфоровую чашку, масса которой 12 г, внесли 20 г насыщенного при 60 °С раствора нитрата калия. После выпаривания раствора масса чашки с солью составила 22,5 г. Вычислите растворимость нитрата калия при 60 °С.
Вычислите массу сульфата калия, содержащегося в 250 г насыщенного при 15 °С раствора, если растворимость соли при этой температуре равна 101 г/л.
Вычислите массу хлорида натрия, содержащегося в 200 г насыщенного при 30 °С раствора, если растворимость соли при этой температуре 381 г/л.
Каковы массы карбоната натрия и воды, которые надо взять для приготовления 400 г насыщенного при 10 °С раствора, если растворимость соли при этой температуре 125,5 г/л?
Каковы массы безводного хлорида кальция и воды, которые необходимо взять для приготовления 150 г насыщенного при 20 °С раствора, если растворимость соли при этой температуре 745 г/л?
Растворимость безводного сульфата натрия при 20 °С равна 192 г/л. Каков минимальный объём воды (в л), необходимый для растворения при этой температуре 217,7 г глауберовой соли Na2SO4*10H2O?
Растворимость безводного сульфата цинка при температуре 30 °С равна 322 г/л. Каков минимальный объём воды (в л), необходимый для растворения при этой температуре 143,5 г ZnSO4*7H2O?
*1-23. Растворимость сульфата калия при 80 и 10 °С соответственно равна 214 и 93 г/л. Сколько сульфата калия (в г) выделится из 60,7 г насыщенного при 80 °С раствора, если его охладить до 10 °С?
*1-24. Растворимость хлорида натрия при 70 и 20 °С соответственно равна 375 и 359 г/л. Сколько хлорида натрия (в г) выделится из 55 г насыщенного при 70 °С раствора, если его охладить до 20 °С?
Тепловые эффекты при растворении.
Кристаллогидраты
Растворение веществ сопровождается поглощением или выделением теплоты. Процессы разрушения кристаллической решётки твёрдых веществ, преодоление сил взаимного притяжения между частицами (молекулами и ионами), диффузия частиц по всему объёму растворителя идут с поглощением энергии (теплоты). Процесс взаимодействия частиц растворяемого вещества и растворителя (в случае водных растворов это процесс образования гидратов) идёт с выделением энергии (теплоты).
Если в ходе растворения веществ выделяется больше энергии, чем затрачивается, процесс растворения является экзотермическим, в противном случае - эндотермическим.
В растворе молекулы воды иногда настолько прочно связываются с частицами растворённого вещества, что при выделении его из раствора вода входит в состав кристаллов вещества и образуются кристаллогидраты. Вода, входящая в состав кристаллогидратов, называется кристаллизационной. Состав кристаллогидратов выражают формулой, в которой указывают соотношение числа молей вещества и воды. В названии кристаллогидрата число молей воды указывают с помощью греческих названий чисел, например CuSO4*5H2O – пентагидрат сульфата меди.
Пример 1. Вычислите массовые доли сульфата меди и воды в медном купоросе CuSO4*5H2O.
Р е ш е н и е. Учитывая, что в 1 моль CuSO4*5H2O содержится 1 моль CuSO4 и 5 моль H2O и что молярные массы CuSO4*5H2O, CuSO4 и H2O соответственно равны 250, 160 и 18 г/моль, найдём массовые доли CuSO4 и H2O.
ω(CuSO4) .
.
ω(H2O) .
.
Пример 2. Какова масса сульфата натрия и воды, содержащихся в 64,4 г глауберовой соли Na2SO4*10H2O?
Р е ш е н и е. Учитывая, что в 1 моль Na2SO4*10H2O содержится 1 моль Na2SO4 и 10 моль H2O и что молярные массы Na2SO4*10H2O, Na2SO4 и H2O соответственно равны 322, 142 и 18 г/моль, найдём массы Na2SO4 и H2O в 64,4 г Na2SO4*10H2O.
а) В 322 г Na2SO4*10H2O содержится 142 г Na2SO4
В 64,4 г Na2SO4*10H2O содержится x г Na2SO4
Откуда
 (г).
(г).
В 64,4 г Na2SO4*10H2O содержится y г H2O
Откуда
 (г).
(г).
Массу воды по известной массе Na2SO4 можно вычислить и по разности: 64,4 г – 28, 4 г = 36 г.
Пример 3. Какова масса воды, присоединяющейся к 33,3 г безводного хлорида кальция при образовании его гексагидрата CaCl2*6H2O?
Р е ш е н и е. Учитывая, что 1 моль CaCl2 может присоединить 6 моль H2O и что молярные массы CaCl2, H2O и CaCl2*6H2O соответственно равны 111, 18 и 219 г/моль, вычислим массу присоединяемой воды.
111 г CaCl2 присоединяет 108 г H2O
33,3 г CaCl2 присоединяет x г H2O
Откуда
 (г).
(г).
1-25. Какие из перечисленных ниже факторов позволяют объяснить, почему при растворении ряда безводных солей в воде наблюдается выделение теплоты: а) частицы соли переходят в раствор; б) идёт разрушение кристаллической решётки твёрдой безводной соли; в) идёт взаимодействие частиц соли с молекулами воды; г) в растворе образуются гидраты; д) при образовании гидратов выделяется энергия; е) при образовании гидратов выделяется больше энергии, чем её затрачивается на разрушение решётки соли?
1-26. Какое уточнение требуется ввести в утверждение, что растворение безводной соли всегда сопровождается выделением теплоты?
1-27. Как объяснить, что растворение Na2CO3*10H2O сопровождается поглощением, а растворение безводного карбоната натрия – выделением теплоты?
1-28. В каких соединениях – NaOH, CuSO4*5H2O, Cu(OH)2, Ba(OH)2*8H2O, Na2CO3*10H2O, H2SO4*2H2O – содержится кристаллизационная вода?
*1-29. Какие из гидратов – K2O*H2O, FeSO4*7H2O, Na2SO4*10H2O, FeO*H2O, CuO*H2O, SrO*9H2O, SO3*H2O, SO3*3H2O, BaCl2*2H2O – называются кристаллогидратами?
1-30. Вычислите массовые доли воды и нитрата меди в Cu(NO3)2*3H2O.
1-31. Вычислите массовую долю воды в CaCl2*6H2O.
1-32. Какова масса карбоната натрия и воды, содержащихся в 11,44 г Na2CO3*10H2O?
1-33. Какова масса сульфата железа (II), содержащегося в 13,9 г FeSO4*7H2O?
1-34. Сколько воды (в г) может соединиться с 4,8 г сульфата меди при образовании CuSO4*5H2O?
1-35. Сколько воды (в г) может соединиться с 5,68 г сульфата натрия при образовании Na2SO4*10H2O?
Вычисление массы раствора по его объёму
и объёма раствора по его массе
Пример 1. Какова масса 500 мл некоторого раствора, если плотность его 1,84 г/см3?
Р е ш е н и е. Воспользовавшись формулой m=Vρ, где m – масса раствора (в г), V – объём раствора (в мл, см3), ρ – плотность раствора (в г/см3), найдём m=500*1,84=920 (г)
Пример 2. Какой объём занимают 525 г некоторого раствора, если плотность его 1,05 г/см3?
Р е ш е н и е. Воспользовавшись формулой V=m:ρ, найдём V=525:1,05=500 (мл).
1-36. Какова масса 150 мл некоторого раствора, если плотность его 1,04 г/см3?
1-37. Какова масса 600 мл некоторого раствора, если плотность его 1,22 г/см3?
1-38. Какой объём (в мл) занимают 240 г раствора, если плотность его 1,2 г/см3?
1-39. Какой объём (в мл) занимают 480 г раствора, если плотность его 1,1 г/см3?
Вычисление массовой доли растворённого вещества
Пример 1. В 800 г раствора содержится 40 г поваренной соли. Какова массовая доля соли в растворе?
Р е ш е н и е. Задачу можно решить, используя формулу:
ω .
.
Пример 2. Какова массовая доля соли в растворе, полученном растворением 20 г нитрата калия в 180 г воды?
Р е ш е н и е. Учитывая, что масса раствора равна 200 г (20 + 180), найдём массовую долю нитрата калия в растворе:
ω(KNO3)
Пример 3. В 1 л воды растворили 3 л сероводорода (при н.у.). Какова массовая доля сероводорода в растворе?
Р е ш е н и е. Учитывая, что масса 22,4 л (молярный объём) H2S равна 34 г, найдём массу 3 л H2S.
Масса 22,4 л H2S равна 34 г
Масса 3 л H2S равна x г
Откуда
 (г).
(г).
Принимая плотность воды равной 1 г/см3, найдём, что масса 1 л воды равна 1000 г. Масса всего раствора равна 4,55+1000=1004,55 (г). Вычислим массовую долю сероводорода:
ω(H2S)=
Пример 4. В 500 г воды растворили 100 г медного купороса (CuSO4*5H2O). Вычислите массовую долю сульфата меди в растворе.
Р е ш е н и е. Масса раствора равна 600 г (100+500). Найдём массу безводного сульфата меди, содержащегося в 100 г медного купороса, учитывая, что молярные массы CuSO4*5H2O и CuSO4 соответственно равны 250 и 160 г/моль.
В 250 г CuSO4*5H2O содержится 160 г CuSO4
В 100 г CuSO4*5H2O содержится x г CuSO4
Откуда
 (г).
(г).
Вычислим массовую долю сульфата меди в растворе:
ω(CuSO4)= .
.
Пример 5. Какова массовая доля карбоната калия в насыщенном при 10 °С растворе, если растворимость соли при этой температуре равна 1092 г/л?
Р е ш е н и е. Учитывая, что масса насыщенного при 10 °С раствора карбоната калия в расчёте на 1000 г воды равна 2092 г (1000+1092), найдём массовую долю карбоната калия в растворе:
ω(K2CO3)
1-40. В 600 г раствора содержится 24 г хлорида кальция. Какова массовая доля соли в растворе?
1-41. В 700 г раствора содержится 14 г сульфата цинка. Какова массовая доля соли в растворе?
1-42. Какова массовая доля соли в растворе, полученном при растворении 50 г хлорида калия в 350 г воды?
1-43. Какова массовая доля сахара в растворе, полученном при растворении 30 г его в 570 г воды?
1-44. В 254 г воды растворили 89,6 л хлороводорода (при н.у.). Какова массовая доля хлороводорода в растворе?
1-45. В 3 л воды растворили 56 л аммиака (при н.у.). Вычислите массовую долю аммиака в растворе.
1-46. В 439,1 г воды растворили 60,9 г MgCl2*6H2O. Какова массовая доля хлорида магния в растворе?
1-47. Какова массовая доля сульфата натрия в растворе, полученном при растворении в 300 г воды 1 моль Na2SO4*10H2O?
1-48. Какова массовая доля хлорида лития в насыщенном при 25°С растворе, если растворимость его при этой температуре 345 г/л?
1-49. Какова массовая доля карбоната натрия в насыщенном при 20 °С растворе, если растворимость его при этой температуре 218 г/л?
Вычисление массы раствора, растворённого
вещества и растворителя
Пример 1. Какова масса 8-процентного раствора сульфата натрия, в котором содержится 40 г этой соли?
Р е ш е н и е. Учитывая, что раствор 8-процентный, составим соотношение:
8 г сульфата натрия содержится в 100 г раствора
40 г сульфата натрия содержится в x г раствора
Откуда
 (г)
(г)
Пример 2. Сколько сахара и воды (в г) необходимо взять для приготовления 600 г 20-процентного раствора?
Р е ш е н и е. Учитывая, что раствор 20-процентный, составим соотношение:
В 100 г раствора содержится 20 г сахара
В 600 г раствора содержится x г сахара
Откуда
 (г).
(г).
Масса воды 480 г (600 – 120).
Задачу можно решить, используя формулу: m(вещества)=m(раствора)* ω. Если раствор 20-процентный, то массовая доля сахара в нем 0,2. Масса сахара в растворе m = 600*0,2=120 (г)
Пример 3. Сколько воды (в г) необходимо взять для растворения 30 г гидроксида калия, чтобы приготовить 15-процентный раствор?
Р е ш е н и е. Вычислим массу 15%-го раствора, содержащего 30 г KOH.
15 г KOH содержится в 100 г раствора
30 г KOH содержится в x г раствора
Откуда
 (г)
(г)
Масса воды, которую нужно взять для приготовления раствора, равна 170 г (200-30).
Пример 4. Сколько воды (в г) необходимо взять для растворения 13,9 г FeSO4*7H2O, чтобы приготовить 10%-ый раствор сульфата железа (II)?
Р е ш е н и е. Учитывая, что молярные массы FeSO4 и FeSO4*7H2O соответственно равны 152 и 278 г/моль, найдём, сколько сульфата железа (в г) содержится в 13,9 г кристаллогидрата.
В 278 г FeSO4*7H2O содержится 152 г FeSO4
В 13,9 г FeSO4*7H2O содержится x г FeSO4
Откуда
 (г)
(г)
Так как раствор должен быть 10%-ым, то
10 г FeSO4 содержится в 100 г раствора
7,6 г FeSO4 содержится в x г раствора
Откуда
 (г)
(г)
Масса добавляемой воды 62,1 г (76 – 13,9).
1-50. Какова масса 15%-го раствора, в котором содержится 60 г соли?
1-51. Сколько сульфата меди и воды (в г) содержится в 600 г 8%-го раствора?
1-52. Сколько хлорида калия и воды (в г) необходимо взять для приготовления 500 г 12%-го раствора?
1-53. Сколько безводного сульфата натрия и воды (в г) необходимо взять для приготовления 600 г 6%-го раствора?
1-54. Сколько воды (в г) необходимо взять для растворения 20 г хлорида натрия, чтобы приготовить 10%-ый раствор соли?
1-55. Сколько воды (в г) необходимо взять для растворения 50 г нитрата натрия, чтобы приготовить 5%-ый раствор соли?
1-56. Сколько воды (в г) необходимо взять для растворения 14,3 г кристаллической соды Na2CO3*10H2O, чтобы приготовить 5,3%-ый раствор Na2CO3?
*1-57. Сколько воды (в г) необходимо взять для растворения 12,1 г Cu(NO3)2*3H2O, чтобы приготовить 5%-ый раствор нитрата меди?
1-58. Сколько глауберовой соли Na2SO4*10H2O и воды (в г) необходимо взять, чтобы приготовить 710 г 10%-го раствора сульфата натрия?
1-59. Сколько кристаллической соды Na2CO3*10H2O и воды (в г) необходимо взять, чтобы приготовить 500 г 10,6%-го раствора карбоната натрия?
Вычисления при разбавлении и приготовлении
более концентрированных растворов
Пример 1. После частичного упаривания 400 г 15%-го раствора поваренной соли было получено 300 г раствора. Вычислите массовую долю поваренной соли в растворе.
Р е ш е н и е. Вычислим, сколько поваренной соли (в г) содержится в 400 г 15%-го раствора.
В 100 г раствора содержится 15 г NaCl
В 400 г раствора содержится x г NaCl
Откуда
 (г)
(г)
Учитывая, что после упаривания 60 г поваренной соли содержится в 300 г раствора, найдём массовую долю NaCl:
ω
Пример 2. К 300 мл (ρ=1,07 г/см3) 10%-го раствора серной кислоты добавили 179 г воды. Какова массовая доля серной кислоты в полученном растворе?
Р е ш е н и е. Масса 300 мл 10%-го раствора серной кислоты равна 300*1,07=321 (г). Найдём массу серной кислоты, содержащейся в этом растворе.
В 100 г раствора содержится 10 г H2SO4
В 321 г раствора содержится x г H2SO4
Откуда
 (г)
(г)
Масса полученного раствора равна 321+179=500 (г). Найдём массовую долю кислоты в нем:
ω(H2SO4)=
Пример 3. В 20 г 20%-го раствора сульфата натрия растворили 4 г глауберовой соли Na2SO4*10H2O. Вычислите массовую долю сульфата натрия в растворе.
Р е ш е н и е. Вычислим, сколько сульфата натрия (в г) содержится в 20 г 20%-го раствора.
В 100 г раствора содержится 20 г Na2SO4
В 20 г раствора содержится x г Na2SO4
Откуда
 (г).
(г).
Учитывая, что молярные массы Na2SO4*10H2O и Na2SO4 соответственно равны 322 и 142 г/моль, найдем, сколько сульфата натрия (в г) содержится в 4 г кристаллогидрата.
В 322 г Na2SO4*10H2O содержится 142 г Na2SO4
В 4 г Na2SO4*10H2O содержится y г Na2SO4
Откуда
 (г).
(г).
Учитывая, что масса конечного раствора равна 20+4=24 (г) и в нем содержится 4+1,76=5,76 (г) сульфата натрия, найдем его массовую долю в растворе:
ω(Na2SO4)= .
.
Пример 4. К 500 г 5%-го раствора гидроксида натрия добавили 250 г 8%-го раствора этого же вещества. Какова массовая доля гидроксида натрия в растворе?
Р е ш е н и е. Вычислим, сколько гидроксида натрия (в г) содержится в 5- и 8%-ом растворах:
а) в 100 г раствора содержится 5 г NaOH
в 500 г раствора содержится x г NaOH
Откуда
 (г).
(г).
б) в 100 г раствора содержится 8 г NaOH
в 250 г раствора содержится y г NaOH
Откуда
 (г).
(г).
Масса полученного раствора равна 500+250=750 (г), в нем содержится 25+20=45 (г) гидроксида натрия. Найдем массовую долю NaOH в конечном растворе:
ω(NaOH)= .
.
Пример 5. Сколько 4%-го раствора азотной кислоты (в г) можно приготовить из 400 г 15%-го ее раствора?
Р е ш е н и е. Вычислим, сколько азотной кислоты (в г) содержится в 400 г 15%-го раствора.
В 100 г раствора содержится 15 г HNO3
В 400 г раствора содержится x г HNO3
Откуда (г).
Вычислим массу 4%-го раствора:
4 г HNO3 содержится в 100 г раствора.
60 г HNO3 содержится в y г раствора
Откуда
 (г).
(г).
Пример 6. Сколько воды (в г) необходимо добавить к 400 г 20%-го раствора гидроксида натрия для приготовления 16%-го раствора?
Р е ш е н и е. Вычислим, сколько гидроксида натрия (в г) содержится в 400 г 20%-го раствора.
В 100 г раствора содержится 20 г NaOH
В 400 г раствора содержится x г NaOH
Откуда
 (г).
(г).
Вычислим массу 16%-го раствора:
16 г NaOH содержится в 100 г раствора
80 г NaOH содержится в y г раствора
Откуда
 500
(г).
500
(г).
К исходному раствору необходимо добавить 500 – 400 = 100 (г) воды.
Пример 7. Сколько 40%-го (ρ=1,25 г/см3) и 10%-го (ρ=1,06 г/см3) растворов азотной кислоты (в мл) необходимо взять, чтобы приготовить 1 л 15%-го раствора (ρ=1,08 г/см3)?
Р е ш е н и е. Масса конечного раствора равна 1000*1,08=1080 (г). Найдем, сколько в растворе должно содержаться HNO3 (в г)
В 100 г раствора должно содержаться 15 г HNO3
В 1080 г раствора должно содержаться x г HNO3
Откуда
 (г).
(г).
Обозначим через y массу 40%-го раствора, тогда масса 10%-го раствора равна (1080 – y) г. Найдем, сколько азотной кислоты (в г) содержится в y г 40%-го раствора и в (1080 – y) г 10%-го раствора.
В 100 г раствора содержится 40 г HNO3
В y г раствора содержится а г HNO3
Откуда
 (г).
(г).
В 100 г раствора содержится 10 г HNO3
В (1080 – y) г раствора содержится b г HNO3
Откуда
 (г).
(г).
Учитывая, что суммарная масса HNO3 в конечном растворе равна 162 г, составим уравнение:
a+b=0,4y+0,1(1080-y)=162.
Решив уравнение, найдем, что y=180 г, т.е. масса 40%-го раствора равна 180 г, а его объем 180:1,25=144(мл); масса 10%-го раствора равна 1080 – 180 = 900 (г), а его объём 900:1,06 = 849 (мл).
Пример 8. Сколько серной кислоты (в г) необходимо добавить к 87,4 мл 5%-го ее раствора (ρ=1,08 г/см3), чтобы приготовить 10%-ый раствор?
Р е ш е н и е. Масса 5%-го раствора равна 87,4*1,08=90 (г). Найдем массу серной кислоты, содержащейся в 90 г 5%-го раствора.
В 100 г раствора содержится 5 г H2SO4
В 90 г раствора содержится x г H2SO4
Откуда
 (г).
(г).
Обозначим через y г массу добавляемой к 5%-ому раствору серной кислоты. Тогда масса конечного раствора будет равна (90+y) г, а масса содержащейся в нем кислоты – (4,5+y) г. Так как конечный раствор должен быть 10%-ым, то:
В 100 г раствора должно содержаться 10 г H2SO4
В (90+y) г раствора должно содержаться (4,5+y) г H2SO4
Откуда
 (г).
(г).
Пример 9. Сколько Na2SO4*10H2O (в г) необходимо добавить к 400 г 8%-го раствора сульфата натрия, чтобы приготовить 12%-ый его раствор?
Р е ш е н и е. Обозначим через x г массу Na2SO4*10H2O. Учитывая, что молярные массы этой соли и сульфата натрия соответственно равны 322 и 142 г/моль, вычислим, сколько безводного сульфата натрия содержится в x г кристаллогидрата.
В 322 г Na2SO4*10H2O содержится 142 г Na2SO4
В x г Na2SO4*10H2O содержится а г Na2SO4
Откуда
 (г).
(г).
Найдем массу Na2SO4 в 400 г 8%-го раствора.
В 100 г раствора содержится 8 г Na2SO4
В 400 г раствора содержится y г Na2SO4
Откуда
 (г).
(г).
Масса конечного раствора равна (400+x) г, в нем содержится (0,44x+32) г Na2SO4. Найдем значение x, учитывая, что конечный раствор должен быть 12%-ым.
В 100 г раствора содержится 12 г Na2SO4
В (400+x) г раствора сдержится (0,44x+32) г Na2SO4
Откуда
 (г).
(г).
1-60. После частичного упаривания 800 г 4%-го раствора сульфата меди получили раствор, масса которого 500 г. Вычислите массовую долю сульфата меди в полученном растворе.
1-61. После частичного упаривания 450 г 9%-го раствора сульфата натрия получили раствор, масса которого уменьшилась на 150 г. Вычислите массовую долю сульфата натрия в растворе.
1-62. К 400 г 10%-го раствора нитрата кальция добавили 100 г воды. Вычислите массовую долю нитрата кальция в растворе.
1-63. К 400 мл 20%-го раствора соляной кислоты (ρ=1,1 г/см3) добавили 360 г воды. Какова массовая доля HCl в растворе?
1-64. В 500 г 4%-го раствора сульфата меди растворили 25 г CuSO4*5H2O. Вычислите массовую долю CuSO4 в растворе.
1-65. В 200 г 5%-го раствора хлорида бария растворили 61 г BaCl2*2H2O. Вычислите массовую долю BaCl2 в растворе.
1-66. К 300 г 15%-го раствора гидроксида калия добавили 200 г 7,5%-го раствора этого же вещества. Какова массовая доля KOH в растворе?
1-67. К 400 мл 28%-го раствора серной кислоты (ρ=1,2 г/см3) добавили 200 мл 10%-го раствора (ρ=1,07 г/см3) этого же вещества. Какова массовая доля Н2SO4 в растворе?
1-68. Сколько 8%-го раствора серной кислоты (в кг) можно приготовить из 600 г 50%-го ее раствора?
1-69. Сколько 12%-го раствора (ρ=0,96 г/см3) аммиака (в мл) можно приготовить из 400 мл 30%-го (ρ=0,9 г/см3) его раствора?
1-70. Сколько воды (в г) необходимо добавить к 500 г 25%-го раствора гидроксида калия, чтобы приготовить 20%-ый раствор?
1-71. Сколько воды (в г) необходимо добавить к 250 г 12%-го раствора азотной кислоты, чтобы приготовить 8%-ый раствор?
1-72. Сколько 60%-го (ρ= 1,4 г/см3) и 6%-го (ρ= 1,03 г/см3) растворов азотной кислоты (в мл) необходимо взять, чтобы приготовить 2 л 10%-го ее раствора (ρ= 1,06 г/см3)?
1-73. Сколько 20%-го (ρ= 1,18 г/см3) и 8%-го (ρ= 1,06 г/см3) растворов гидроксида калия (в мл) необходимо взять, чтобы приготовить 400 мл 15%-го его раствора (ρ= 1,13 г/см3)?
1-74. Сколько гидроксида натрия (в г) необходимо добавить к 60 мл 8%-го (ρ= 1,2 г/см3) его раствора, чтобы приготовить 20%-ый раствор?
1-75. Сколько гидроксида калия (в г) необходимо добавить к 100 мл 12%-го его раствора (ρ= 1,1 г/см3), чтобы приготовить 25%-ый раствор?
1-76. Сколько медного купороса CuSO4*5H2O (в г) необходимо добавить к 200 г 5%-го раствора сульфата меди, чтобы приготовить 9%-ый раствор этой соли?
1-77. Сколько кристаллической соды Na2CO3*10H2O (в г) необходимо добавить к 300 г 4%-го раствора карбоната натрия, чтобы приготовить 10%-ый раствор этой соли?
Вычисления по уравнениям реакций,
протекающих в растворах
Пример 1. Сколько 8%-го раствора гидроксида натрия (в г) потребуется для нейтрализации 200 г 9,8%-го раствора серной кислоты?
Р е ш е н и е. Найдем, сколько серной кислоты (в г) содержится в 200 г 9,8%-го раствора.
В 100 г раствора содержится 9,8 г H2SO4
В 200 г раствора содержится x г H2SO4
Откуда
 (г).
(г).
Напишем уравнение реакции нейтрализации:

Вычислим, сколько NaOH (в г) потребуется для нейтрализации 19,6 г H2SO4:
98 г H2SO4 взаимодействуют с 80 г NaOH
19,6 г H2SO4 взаимодействуют с y г NaOH
Откуда
 (г).
(г).
Найдем массу 8%-го раствора, содержащего 16 г NaOH.
В 100 г раствора содержится 8 г NaOH
В z г раствора содержится 16 г NaOH
Откуда
 (г).
(г).
Пример 2. Сколько 16%-го раствора сульфата меди (II) и 10%-го раствора гидроксида натрия (в г) потребуется для получения 39,2 г гидроксида меди?
Р е ш е н и е. Напишем уравнение реакции образования гидроксида меди:

Вычислим, сколько CuSO4 и NaOH (в г) необходимо взять для получения 39,2 г Cu(OH)2.
Для получения 98 г Cu(OH)2 потребуется 160 г CuSO4
Для получения 39,2 г Cu(OH)2 потребуется x г CuSO4
Откуда
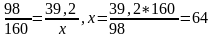 (г).
(г).
Для получения 98 г Cu(OH)2 потребуется 80 г NaOH
Для получения 39,2 г Cu(OH)2 потребуется y г NaOH
Откуда
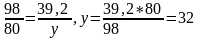 (г).
(г).
Найдем массы 16%-го раствора сульфата меди и 10%-го раствора гидроксида натрия, Содержащих соответственно 64 и 32 г этих веществ.
В 100 г раствора содержится 16 г CuSO4
В z г раствора содержится 64 г CuSO4
Откуда
 (г).
(г).
В 100 г раствора содержится 10 г NaOH
В а г раствора содержится 32 г NaOH
Откуда
 (г).
(г).
Пример 3. Сколько сульфида меди (в г) образуется, если к 400 г 8%-го раствора сульфата меди добавить 300 г 2,6%-го раствора сульфида натрия?
Р е ш е н и е. Вычислим, сколько CuSO4 (в моль) содержится в 400 г 8%-го раствора и сколько Na2S (в моль) содержится в 300 г 2,6%-го его раствора.
В 100 г раствора содержится 8 г CuSO4
В 400 г раствора содержится x г CuSO4
Откуда
 (г),
или 0,2 моль CuSO4.
(г),
или 0,2 моль CuSO4.
в 100 г раствора содержится 2,6 г Na2S
в 300 г раствора содержится y г Na2S
Откуда
 (г),
или 0,1 моль Na2S.
(г),
или 0,1 моль Na2S.
Напишем уравнение реакции образования сульфида меди:

Так как CuSO4 взят в избытке (0,2 моль CuSO4 на 0,1 моль Na2S, а в реакцию они вступают в соотношении числа молей 1*1), расчет следует вести по числу молей Na2S.
Из 1 моль Na2S образуется 96 г (1 моль) CuS
Из 0,1 моль Na2S образуется a г CuS
Откуда
 (г).
(г).
Пример 4. Через 157,5 мл 6%-го раствора (ρ= 1,06 г/см3) гидроксида натрия пропустили 5,6 л углекислого газа (при н.у.). Какая соль образуется при этом и какова ее массовая доля?
Р е ш е н и е. При взаимодействии углекислого газа со щелочью, в зависимости от их количественного соотношения, может протекать одна из двух реакций:
CO2+2NaOH=Na2CO3+H2O;
CO2+NaOH=NaHCO3.
Из уравнений реакций следует, что при молярном соотношении υ(CO2):υ(NaOH) = 1:2 образуется средняя соль карбонат натрия, при соотношении 1:1 образуется кислая соль – гидрокарбонат натрия. Вычислим число молей вступивших в реакцию CO2 и NaOH и их молярное соотношение.
υ(CO2)= (моль);
(моль);
m (р-ра NaOH) = ρ*V=1,06*157,5=166,95 (г);
m (NaOH) = 166,95*0,06 = 10,02 (г);
υ(NaOH)
=
 (моль)
(моль)
Отношение υ (CO2):υ(NaOH) = 0,25:0,25 = 1. Следовательно, образуется гидрокарбонат натрия. Находим его массу, учитывая, что M(NaHCO3)=84 г/моль.
m(NaHCO3)=84*0,25=21 (г).
Масса полученного раствора равна сумме масс раствора гидроксида натрия и углекислого газа: m (р-ра) = 166,9 + 44*0,25 = 177,95 (г).
ω(NaHCO3)= .
.
1-78. Сколько 11,2%-го раствора гидроксида калия (в г) потребуется для нейтрализации 300 г 19,6%-го раствора серной кислоты?
1-79. Сколько 20%-го раствора азотной кислоты (в г) потребуется для нейтрализации 400 г 9,25%-го раствора гидроксида кальция?
1-80. Сколько 9%-го раствора карбоната калия и 12%-го раствора хлорида кальция (в г) потребуется для получения 30 г карбоната кальция?
1-81. Сколько 5%-го раствора сульфата натрия и 6%-го раствора нитрата бария (в г) потребуется для получения 13,98 г сульфата бария?
1-82. Сколько гидроксида магния (в г) образуется, если к 320 г 15%-го раствора сульфата магния добавить 250 г 16%-го раствора гидроксида натрия?
1-83. Сколько хлорида серебра (в г) образуется, если к 500 г 14%-го раствора нитрата серебра добавить 146 г 10%-го раствора соляной кислоты?
1-84. Какого состав соль образуется и какова ее массовая доля в растворе, полученном при пропускании 28 л углекислого газа (при н.у.) через 300 г раствора гидроксида калия с массовой долей этого вещества 23,3%?
1-85. Газ, образовавшийся при сжигании 33,6 л сероводорода (при н.у.), растворили в 375 мл 25%-го раствора (ρ = 1,28 г/см3) гидроксида натрия. Какая соль образовалась при этом и какова ее массовая доля в растворе?
