
- •Термодинамическое определение.
- •Энтропия и критика эволюционизма
- •Адиабатический
- •Изотермический
- •Изохорический
- •Физические основы зонной теории.
- •Зонная структура различных материалов.
- •Спектр водорода.
- •Постулаты Бора.
- •Принцип действия.
- •Устройство лазера.
- •Применение лазеров.
- •Контакт электронного и дырочного полупроводников.
Фотоэффект и его разновидности.
Законы внешнего и внутреннего фотоэффекта (Столетова).
Фотоэффе́кт — это испускание электронов веществом под действием электромагнитного излучения.
Внешним фотоэлектрическим эффектом (фотоэффектом) называется испускание электронов веществом под действием электромагнитного излучения. Внешний фотоэффект наблюдается в твердых телах (металлах, полупроводниках, диэлектриках), а также в газах на отдельных атомах и молекулах (фотоионизация). Фотоэффект обнаружен (1887 г.) Г. Герцем, наблюдавшим усиление процесса разряда при облучении искрового промежутка ультрафиолетовым излучением.
Внутренний фотоэффект — это вызванные электромагнитным излучением переходы электронов внутри полупроводника или диэлектрика из связанных состояний в свободные без вылета наружу. В результате концентрация носителей тока внутри тела увеличивается, что приводит к возникновению фотопроводимости (повышению электропроводности полупроводника или диэлектрика при его освещении) или к возникновению э.д.с.
Вентильный фотоэффект, являющийся разновидностью внутреннего фотоэффекта, — возникновение э.д.с. при освещении контакта двух разных полупроводников или полупроводника и металла (при отсутствии внешнего электрического поля). Вентильный фотоэффект открывает, таким образом, пути для прямого преобразования солнечной энергии в электрическую.
Многофотонный фотоэффект возможен, если интенсивность света очень большая (например, при использовании лазерных пучков). При этом электрон, испускаемый металлом, может одновременно получить энергию не от одного, а от нескольких фотонов.
Ядерный
фотоэффект.
При поглощении гамма-кванта ядро получает
избыток энергии без изменения
своего нуклонного состава,
а ядро с избытком энергии является составным
ядром.
Как и другие ядерные
реакции,
поглощение ядром гамма-кванта возможно
только при выполнении необходимых
энергетических и спиновых соотношений.
Если переданная ядру энергия
превосходит энергию
связи нуклона
в ядре, то распад образовавшегося
составного ядра происходит чаще всего
с испусканием нуклонов, в основном нейтронов.
Такой распад ведёт к ядерным реакциям ![]() и
и ![]() ,
которые и называются фотоядерными,
а явление испускания нуклонов (нейтронов
и протонов)
в этих реакциях — ядерным
фотоэффектом.
,
которые и называются фотоядерными,
а явление испускания нуклонов (нейтронов
и протонов)
в этих реакциях — ядерным
фотоэффектом.
I. Закон Столетова: при фиксированной частоте падающего света число фотоэлектронов, вырываемых из катода в единицу времени, пропорционально интенсивности света (сила фототока насыщения пропорциональна энергетической освещенности Ее катода).
II. Максимальная начальная скорость (максимальная начальная кинетическая энергия) фотоэлектронов не зависит от интенсивности падающего света, а определяется только его частотой n.
III. Для каждого вещества существует красная граница фотоэффекта, т. е. минимальная частота n0 света (зависящая от химической природы вещества и состояния его поверхности), ниже которой фотоэффект невозможен.
Красная граница фотоэффекта (внутреннего и внешнего).
«Красная»
грани́ца фотоэффе́кта —
минимальная частота света ![]() ,
при которой еще возможен внешний
фотоэффект,
то есть начальная кинетическая
энергияфотоэлектронов
больше нуля. Частота
зависит
только от работы
выхода электрона:
,
при которой еще возможен внешний
фотоэффект,
то есть начальная кинетическая
энергияфотоэлектронов
больше нуля. Частота
зависит
только от работы
выхода электрона:
![]() ,
,
где A — работа
выхода для
конкретного фотокатода,
а h — постоянная
Планка. Работа
выхода A зависит
от материала фотокатода и
состояния его поверхности. Испускание
фотоэлектронов начинается сразу же,
как только на фотокатод падает свет с частотой ![]() .
.
Красная граница фотоэффекта:
С уменьшением частоты падающего света, уменьшается поглощенная энергия, и когда она станет равна работе выхода , фототок прекратится. h*на частоту =работе выхода.
Предположение Планка. Уравнение Эйнштейна.
Фотоэффект — это испускание электронов веществом под действием света (и, вообще говоря, любого электромагнитного излучения).
Предположение планка:
Излучение не только испускается но и поглащается и распространяется отдельными порциями-квантами каждый из которых имеет энергию: E=h*на частоту.
Уравнение Эйнштейна:
h*на частоту= А выхода+mv в квадрате/2.
Работа выхода электрона из металла зависит только от природы вещества для данного фотокатода, скорость фотоэлектрона зависит от частоты и интенсивности световой волны.
Идеальный газ. Три пункта состояния.
Основные процессы.
Идеальный газ – математическая модель идеального газа, в которой полагается, что потенциальную энергию можно пренебречь по сравнению с кинетической. Между молекулами не действуют силы притяжения или отталкивания.
Идеальным называют газ, молекулы которого имеют пренебрежимо малый собственный объем и не взаимодействует друг с другом на расстоянии.
Основные изопроцессы:
Изотермический: зависимость между давлением и объёмом, температура постоянна. Он описывается законом Бойля—Мариотта: pV = const
Изобарный процесс – зависимость между температурой и объемом, давление постоянно. Уравнение этого процесса имеет вид V/T = const прир = const и называется законом Гей-Люссака
Изохорный процесс – зависимость между давлением и температурой, объем постоянен. Для него справедлив закон Шарля: V = const, p/T = const
Радиоактивность и ее разновидности.
Радиоактивность – превращение неустойчивых изотопов одного химического элемента в изотопа другого, сопровождающих испусканием некоторых частиц и выделением энергии.
Виды:
Естественная – это радиоактивность наблюд. У изотопов существующих в природе.
Искусственная – изотопы, полученные посредством ядерных реакций. Могут быть получены у любого химического элемента, если бомбардировать их ядро.
Закон радиоактивного распада. Виды распадов.
Закон радиоактивного распада — закон, открытый Фредериком Содди и Эрнестом Резерфордом экспериментальным путём и сформулированный в 1903 году. Современная формулировка закона:
![]() ,
,
что
означает, что число распадов за интервал
времени ![]() в
произвольном веществе пропорционально
числу имеющихся в образце атомов
в
произвольном веществе пропорционально
числу имеющихся в образце атомов ![]() .
.
В
этом математическом выражении ![]() —
постоянная распада, которая
характеризует вероятность радиоактивного
распада за единицу времени и имеющая
размерность с−1.
Знак минус указывает на убыль числа
радиоактивных ядер со временем.
—
постоянная распада, которая
характеризует вероятность радиоактивного
распада за единицу времени и имеющая
размерность с−1.
Знак минус указывает на убыль числа
радиоактивных ядер со временем.
Этот закон считается основным законом радиоактивности, из него было извлечено несколько важных следствий, среди которых формулировки характеристик распада — среднее время жизни атома и период полураспада.
Экспериментально было установлено, что радиоактивное излучение неоднородно и состоит из нескольких видов лучей: в магнитном поле узкий пучок радиоактивного излучения расщепляется на три компонента:
слабо отклоняемый пучок положительных α – лучей.
сильно отклоняемый пучок отрицательных β – лучей.
неотклоняемый пучок γ – лучей.
Исследование этих компонентов позволило выяснить их природу и основные свойства.
α
– излучение представляет
собой поток моноэнергетических ядер
гелия
![]() .
Эти лучи вызывают почернение фотопластинок,
производят сильное ионизирующее действие
при прохождении через газы и обладают
относительно малой проникающей
способностью.
.
Эти лучи вызывают почернение фотопластинок,
производят сильное ионизирующее действие
при прохождении через газы и обладают
относительно малой проникающей
способностью.
Распад протекает по следующей схеме:
![]() .
.
Буквой Х обозначен химический символ распадающегося (материнского) ядра, буквой Y – химический символ образующегося (дочернего) ядра.
β
– излучение
представляет собой поток быстрых
электронов. Их энергия может достигать
10 МэВ, что соответствует скорости,
близкой к скорости света. У них средняя
проникающая способность. В случае
![]() распада ядра испускают поток позитронов
– античастиц с зарядом, равным +е.
распада ядра испускают поток позитронов
– античастиц с зарядом, равным +е.
Существуют три разновидности β – распада. В одном случае ядро, претерпевающее превращение, испускает электрон, в другом – позитрон, в третьем случае, называемом К – захватом (или электронным захватом), ядро поглощает один из электронов К – слоя атома (значительно реже происходит L – и М – захват, т.е. поглощение электрона из L – или М – слоя).
Первый вид распада (β- - распад ) протекает по схеме:
![]() .
.
Второй вид распада (β+ - распад) протекает по схеме:
![]() .
.
Третий вид β – распада (К – захват или е – захват) протекает по следующей схеме:
![]() .
.
γ
– лучи
представляют собой жесткое электромагнитное
излучение с длиной волны, не превышающей
10-11
м, т.е. 0,1
![]() .
Они испускаются дочерним ядром при
переходе его из возбужденного в нормальное
или менее возбужденное состояние. У них
наибольшая из всех радиоактивных
излучений проникающая способность, но
относительно слабая способность к
ионизации.
.
Они испускаются дочерним ядром при
переходе его из возбужденного в нормальное
или менее возбужденное состояние. У них
наибольшая из всех радиоактивных
излучений проникающая способность, но
относительно слабая способность к
ионизации.
В основе экспериментальных методов наблюдения и регистрации радиоактивных излучений (α и β – частиц, γ – квантов) лежит их способность вызывать ионизацию атомов среды, в который они распространяются, почернение фотоэмульсии, а также явление некоторых веществ.
Дефект массы. Энергия связи ядер.
Нуклоны в ядре прочно удерживаются ядерными силами. Для того чтобы удалить нуклон из ядра, надо совершить большую работу, т. е. сообщить ядру значительную энергию.
Энергия связи атомного ядра Есв характеризует интенсивность взаимодействия нуклонов в ядре и равна той максимальной энергии, которую необходимо затратить, чтобы разделить ядро на отдельные невзаимодействующие нуклоны без сообщения им кинетической энергии. У каждого ядра своя энергия связи. Чем больше эта энергия, тем более устойчиво атомное ядро. Точные измерения масс ядра показывают, что масса покоя ядра mя всегда меньше суммы масс покоя, составляющих его протонов и нейтронов. Эту разность масс называют дефектом массы:
![]()
Именно эта часть массы Дт теряется при выделении энергии связи. Применяя закон взаимосвязи массы и энергии, получим:
![]()
где mн- масса атома водорода.
Такая замена удобна для проведения расчетов, и расчетная ошибка, возникающая при этом, незначительна. Если в формулу энергии связи подставить Дт в а.е.м. то для Есв можно записать:
![]()
Важную информацию о свойствах ядер содержит зависимость удельной энергии связи от массового числа А.
Удельная энергия связи Еуд - энергия связи ядра, приходящаяся на 1 нуклон:
![]()
α ,β ,γ излучения.
См:, вопрос 6.
Макроскопические состояния. Термодинамическое равновесие.
МАКРОСКОПИЧЕСКОЕ СОСТОЯНИЕ (макросостояние) системы - определяется значениями ее термодинамических параметров: давления p, температуры Т, удельного объема v, внутренней энергии U и т. п. Для определения макроскопического состояния однокомпонентной системы достаточно знать значения любых 2 независимых параметров (напр., Т и p или Т и v).
МИКРОСКОПИЧЕСКОЕ СОСТОЯНИЕ (микросостояние) системы - определяется в классической механике заданием координат и импульсов всех частиц системы. В квантовой механике микроскопическое состояние - квантовое состояние системы, определяемое набором соответствующих квантовых чисел частиц.
Термодинамическое равновесие — состояние системы, при котором остаются неизменными по времени макроскопические величины этой системы (температура, давление, объем, энтропия). В общем, эти величины не являются постоянными, они лишь флуктуируют (колеблются) возле своих средних значений.
Статические и термодинамические методы.
Процессы, изучаемые молекулярной физикой, являются результатом совокупного действия огромного числа молекул. Законы поведения огромного числа молекул, являясь статистическими закономерностями, изучаются с помощью статистического метода. Этот метод основан на том, что свойства макроскопической системы, в конечном счете, определяются свойствами частиц системы, особенностями их движения и усредненными значениями динамических характеристик этих частиц.
Например, температура тела определяется скоростью движения его молекул, но так как в любой момент времени различные молекулы имеют различные скорости, то температура может быть выражена через усредненное значение скорости движения молекул.
ОПРЕДЕЛЕНИЕ: Термодинамика – это раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями.
Термодинамика не рассматривает микропроцессы, которые лежат в основе этих превращений – этим термодинамический метод отличается от статистического. Термодинамический метод несколько ограничен, т.к. термодинамика ничего не говорит о микроскопическом строении вещества, о механизме явлений, а лишь устанавливает связи между макроскопическими свойствами вещества.
Макроскопические параметры.
Температу́ра (от лат. temperatura — надлежащее смешение, нормальное состояние) — скалярная физическая величина, характеризующая приходящуюся на одну степень свободы среднюю кинетическую энергию частиц макроскопической системы, находящейся в состоянии термодинамического равновесия.
Термодинамическое определение.
Существование равновесного состояния называют первым исходным положением термодинамики. Вторым исходным положением термодинамики называют утверждение о том, что равновесное состояние характеризуется некоторой величиной, которая при тепловом контакте двух равновесных систем становится для них одинаковой в результате обмена энергией. Эта величина называется температурой.
Объём — количественная характеристика пространства, занимаемого телом или веществом. Объём тела или вместимость сосуда определяется его формой и линейными размерами. С понятием объёма тесно связано понятие вместимость, то есть объём внутреннего пространства сосуда, упаковочного ящика и т. п. Синонимом вместимости частично является ёмкость, но словом ёмкость обозначают также сосуды.
Давле́ние (P) — физическая величина, равная силе F, действующей на единицу площади поверхности S перпендикулярно этой поверхности. В данной точке давление определяется как отношение нормальной составляющей силы Fn, действующей на малый элемент поверхности, к его площади:
![]()
Среднее давление по всей поверхности есть отношение силы к площади поверхности:
![]()
Давление характеризует состояние сплошной среды и является диагональной компонентой тензора напряжений. В простейшем случае изотропной равновесной неподвижной среды давление не зависит от ориентации. Давление можно считать также мерой запасённой в сплошной среде потенциальной энергии на единицу объёма и измерять в единицах энергии, отнесённых к единице объёма.
Давление является интенсивной физической величиной. Давление в системе СИ измеряется в паскалях (ньютонах на квадратный метр, или, что эквивалентно, джоулях на кубический метр);
Энтропи́я (от греч. ἐντροπία — поворот, превращение) в естественных науках — мера беспорядка системы, состоящей из многих элементов. В частности, в статистической физике — мера вероятностиосуществления какого-либо макроскопического состояния; в теории информации — мера неопределённости какого-либо опыта (испытания), который может иметь разные исходы, а значит и количествоинформации; в исторической науке, для экспликации феномена альтернативности истории (инвариантности и вариативности исторического процесса).
![]() ,
,
где dS — приращение энтропии; δQ — минимальная теплота подведенная к системе; T — абсолютная температура процесса.
Уравнение состояния идеального газа и его физический смысл (Уравнение Менделеева—Клапейрона.)
Состояние данной массы газа полностью определено, если известны его давление, температура и объем. Эти величины называют параметрами состояния газа. Уравнение, связывающее параметры состояния, называют уравнением состояния. Для произвольной массы газа состояние газа описывается уравнением Менделеева—Клапейрона: pV = mRT/M, где р — давление, V — объем, m — масса, М — молярная масса, R — универсальная газовая постоянная. Физический смысл универсальной газовой постоянной в том, что она показывает, какую работу совершает один моль идеального газа при изобарном расширении при нагревании на 1 К (R = 8,31 ДжДмоль • К)). Уравнение Менделеева—Клапейрона показывает, что возможно одновременное изменение трех параметров, характеризующих состояние идеального газа. Однако многие процессы в газах, происходящие в природе и осуществляемые в технике, можно рассматривать приближенно как процессы, в которых изменяются лишь два параметра. Особую роль в физике и технике играют три процесса: изотермический, изохорный и изобарный.
Внутренняя энергия системы (Связь с первым началом термодинамики).
Внутренняя энергия системы может изменяться за счет энергии, сообщаемой системе извне. Эта энергия может сообщаться системе посредством двух процессов: либо за счет работы, производимой внешними силами над системой, либо за счет передачи ей тепла. Рассмотрим газ, сжимаемый в сосуде поршнем под действием силы F. Пусть под действием этой силы поршень переместился на расстояние dh, сжав газ. Работа силы на пути dh ‑ dA = Fdh. (2.30)
Разделив величину силы на площадь поршня, получим давление P, а умножив на S, получим изменение объема газа dV . Таким образом, производимая над газом работа
dA= PdV.
Такую же по величине работу совершает газ при расширении, перемещая поршень. При этом dV положительно, если газ расширяется, и отрицательно при сжатии газа. Соответственно работа dA положительна или отрицательна: в первом случае система производит работу сама, во втором — внешние силы производят работу над системой.
Графически процесс изменения состояния газа при его расширении или сжатии изображается на кривой P, V участком 1-2 на рис. Полная работа, совершаемая газом, при расширении от V1 до V2:
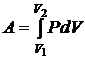 .
(2.31)
.
(2.31)
Эта работа численно равна заштрихованной площади, заключенной под кривой P(V).
Рассмотрим способы передачи телу тепла. При соприкосновении тел либо при взаимодействии тел через излучение, изменение внутренней энергии происходит за счет передачи энергии хаотически движущихся частиц одного тела частицам другого.
Энергия, передаваемая от одного тела другому, представляет собой теплоту. Обозначим ее через Q. Теплота измеряется в тех же единицах, что и энергия.
Связь между переданным теплом, изменением внутренней энергии системы и произведенной работой выражается уравнением
dQ = dE + dA = dE + PdV. (2.32)
Это уравнение представляет собой закон сохранения энергии применительно к механической и тепловой энергии макроскопических тел. Он получил название первого начала термодинамики.
Внутренняя энергия идеального газа и способы ее изменения (к изопроцессам первоначала термодинамики).
Понятие полной и внутренней энергии термодинамической системы. Как мы уже знаем, термодинамическая система (ТС) может состоять из твердых, жидких или газообразных веществ. Полная энергия такой системы, очевидно, состоит из механической энергии системы как целого, внутренней энергии совокупности взаимодействующих между собой и хаотически движущихся частиц и энергии ядерного взаимодействия нуклонов атомов системы.
С точки зрения термодинамики под внутренней энергией тела понимают сумму кинетической энергии хаотического движения составляющих ее частиц и потенциальной энергии их взаимодействия.
![]() .
.
внутренняя энергия идеального газа прямо пропорциональна произведению давления p на объем V, занимаемый газом.
Два способа изменения внутренней энергии — теплопередача и совершение механической работы. Внутренняя энергия тела может изменяться только в результате его взаимодействия с другими телами. При механическом взаимодействии тел мерой энергии, переданной от одного тела к другому, является работа А. При осуществлении теплопередачи от одного тела к другому мерой переданной энергии является количество теплоты Q. Совершение механической работы называется макроскопическим способом передачи энергии, а теплопередача — микроскопическим.
Первое и второе начало термодинамики.
Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии для термодинамических систем.
В любой изолированной системе запас энергии остаётся постоянным. Это — формулировка Дж. П. Джоуля (1842 г.).
Простой пример – маятник, кинетическая энергия которого периодически переходит в потенциальную и обратно, причем это могло бы продолжаться до бесконечности, если бы энергия не рассеивалась из-за трения.
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
Второе начало термодинамики гласит, что невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому.
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не должна равняться 0.
Второе начало термодинамики является постулатом, не доказываемым в рамках термодинамики. Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения.
Другая формулировка второго начала термодинамики основывается на понятии энтропии:
«Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии).
Такая формулировка основывается на представлении об энтропии как о функции состояния системы, что также должно быть постулировано.
Второе начало термодинамики в аксиоматической формулировке Рудольфа Юлиуса Клаузиуса (R. J. Clausius, 1865) имеет следующий вид:
Для любой квазиравновесной термодинамической системы существует однозначная функция термодинамического состояния S = S(T,x,N), называемая энтропией, такая, что ее полный дифференциал dS = δQ / T.
В состоянии с максимальной энтропией макроскопические необратимые процессы (а процесс передачи тепла всегда является необратимым из-за постулата Клаузиуса) невозможны.
