
- •Работа 1 окислительно-восстановительные реакции
- •Основные теоретические положения
- •Порядок выполнения работы
- •Контрольные задания Вариант 1
- •Вариант 2
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Работа 2 гальванические элементы
- •Основные теоретические положения
- •Порядок выполнения работы
- •Экспериментальные и расчетные данные
- •Контрольные задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •1. Никелевый и кобальтовый электроды помещены в растворы их солей. В каком соотношении должны быть взяты концентрации ионов данных металлов, чтобы их потенциалы были одинаковыми?
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Электролиз
- •Основные теоретические положения
- •Порядок выполнения работы
- •Часть 1. Определение электрохимического эквивалента меди
- •Часть 2. Газометрический метод определения выхода продуктов электролиза по току
- •Экспериментальные и расчетные данные для определения электрохимического эквивалента меди
- •Экспериментальные и расчетные данные для процесса электролиза раствора гидроксида натрия
- •Часть 3. Электрохимическое цинкование
- •Экспериментальные и расчетные данные для процесса цинкования
- •Часть 1. Определение электрохимического эквивалента меди
- •Часть 2. Газометрический метод определения выхода продуктов электролиза по току
- •Часть 3. Электрохимическое цинкование
- •Контрольные задания
- •Коррозия металлов
- •Основные теоретические положения
- •Порядок выполнения работы
- •Контрольные задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Определение электропроводимости раствора уксусной кислоты
- •Основные теоретические положения
- •Порядок выполнения работы
- •Контрольные задания Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Библиографический список
- •Третьяков ю.Д. Практикум по неорганической химии: Учеб. Пособие. – м.: Академия, 2004.
- •Стандартные электродные потенциалы окислительно-восстановительных систем в водных растворах
- •Приложение 2 Метрологическая карта средств измерения
- •Давление насыщенного водяного пара при различных температурах
- •Подвижности ионов при 25°с и бесконечном разведении
- •Часть 3
- •162600, Г. Череповец, пр. Луначарского, 5
Порядок выполнения работы
Приборы и реактивы: сосуд для электролиза; прибор для электролиза воды; лабораторный блок питания HY1503D; секундомер; термометр; барометр; весы аналитические; электроды: медные, цинковый, железный; весы аналитические; сушильный шкаф; наждачная бумага; фильтровальная бумага; защитные очки; пинцет; ацетон; электролит № 1 – CuSO4 · 5H2O – 250 г/л, H2SO4 – 50 г/л, C2H5OH – 50 г/л; электролит № 2 – 3 М раствор NaOH; электролит № 3 – ZnSO4 · 7H2O – 215 г/л, Al2(SO4)3·18H2O – 30 г/л, Na2SO4 ·10H2O – 50 г/л, декстрин – 10 г/л.
Х о д р а б о т ы
Часть 1. Определение электрохимического эквивалента меди
1. Получить у преподавателя значение силы тока (не более 1 А) и времени электролиза, данные занести в табл.2.
2. В сосуд для электролиза на ¾ объёма налить электролит № 1.
3. Медный катод (более тонкий электрод) зачистить наждачной бумагой, промыть дистиллированной водой, промокнуть фильтровальной бумагой.
4. Протереть оба электрода ацетоном, высушить на воздухе.
5. Катод взвесить на аналитических весах, массу записать в табл. 2.
6. Закрепить оба медных электрода в крышке сосуда для электролиза.
7. Подключить электроды к полюсам лабораторного блока питания: толстый электрод (анод) к «+», а тонкий электрод (катод) к «–».
8. С помощью регулятора на блоке питания установить заданную преподавателем силу тока. Внимание: плотность тока (отношение силы тока к площади катода) не должна превышать 20 мА/см2 для предотвращения выделения меди в виде черного порошка.
9. Включить секундомер. По истечении заданного времени установку отключить.
10. Отсоединить катод, промыть его дистиллированной водой, высушить в сушильном шкафу в течение 10 минут.
11. Катод взвесить на аналитических весах, массу записать в табл. 2.
12. Опыт повторить при тех же условиях. Данные внести в табл. 2.
Часть 2. Газометрический метод определения выхода продуктов электролиза по току
Эксперимент проводится с помощью прибора для демонстрации электролиза воды типа ОХ-2 (см. рис. 3). Основным элементом прибора является U-образный сосуд (2), служащий электролизером. К сосуду припаяны два эвдиометра (3) с кранами для сбора выделяющихся при электролизе газов: водорода и кислорода. Электролизер имеет два боковых патрубка (6), в которых установлены резиновые пробки (7) с электродами (5) из нержавеющей стали. Электроды выполнены в виде гофрированных цилиндров. На стойке прибора закреплена колба (4) с краном. Колба служит для заливки электролизера раствором. Электролизер устанавливается на подставке (1) с пружинным зажимом и снабжается в нижней части краном для слива жидкости.
Внимание: перед началом выполнения работы надеть защитные очки!
Таблица 2
Экспериментальные и расчетные данные для определения электрохимического эквивалента меди
|
№ опыта |
Сила тока I, А |
Время электролиза τ, с |
Масса катода, г |
Изменение массы катода, г |
Электрохимический эквивалент, г/Кл |
П, % |
|||
|
до опыта mнач |
после опыта mкон |
∆mопыт |
∆mтеор |
kЭ(опыт) |
kЭ(теор) |
||||
|
1 |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
Проведение эксперимента
1. Получить у преподавателя значение силы тока и времени электролиза, данные занести в табл.3.
2. С помощью термомета и барометра измерить температуру и давление в лаборатории, данные занести в табл.3.
3. Подключить прибор к лабораторному блоку питания.
4. Колбу (4) заполнить до половины емкости электролитом № 2. Одновременно открыть оба крана колбы и при открытых кранах эвдиометров перепустить раствор в электролизер, при этом эвдиометры заполняются по высоте до кранов.
5. Закрыть краны эвдиометров, оставив открытым кран колбы.
6. Регулятором на блоке питания установить заданную преподавателем силу тока и провести электролиз. Через указанное время установку отключить.
7. Измерить объемы выделившихся газов, результаты записать в таблицу 3.
8. Опыт повторить при тех же условиях.
9. После отключения прибора промыть дистиллированной водой колбу, эвдиометры и электролизер.
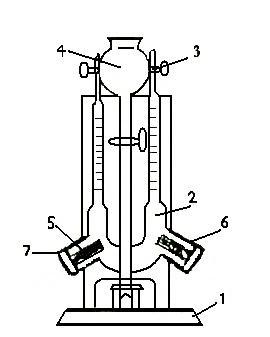
Рис. 3. Прибор для демонстрации электролиза воды
Таблица 3
