
- •Розробка дидактичного забезпечення для вивчення теми “Алюміній” у класах з поглибленим вивченням хімії
- •Розділ і. Літературний огляд
- •1.1 Вивчення теми «Алюміній» у загальноосвітній і профільній школах
- •1.2 Тестування як метод контролю у школах з поглибленим вивченням хімії
- •Розділ іі. Розробка дидактичного матеріалу для вивчення теми «Алюміній»
- •2.1 Розробка наочних посібників
- •2.2 Розробка плану - конспекту уроку на тему «Алюміній як хімічний елемент і проста речовина. Фізичні та хімічні властивості алюмінію»
- •Хід уроку:
- •Алюміній оксид Аl 2o3
- •Алюміній гідроксид Al(oh)3
- •2.3 Тестові завдання на тему: «Алюміній. Добування Алюмінію»
- •Висновки
- •Література
Розділ іі. Розробка дидактичного матеріалу для вивчення теми «Алюміній»
2.1 Розробка наочних посібників
У класах з поглибленим вивченням хімії можна використати як наочні посібники набори, такі як:
«Алюминий» Министерство просвещения РСФСР Главучтехпром Ф-ка №14 «Природа и школа». Тип. «Гудок» Зак.82-75


«Коллекция металлы и сплавы» Министерство просвещения РСФСР Главучтехпром «Природа и школа» Тип. Комб.14 1987.г3 1048. Ту 79 РСФСР 179-84


Також можна використовувати як наочність на уроках хімії при вивченні теми добування Алюмінію плакати «Электролизер для получения Алюминия»:
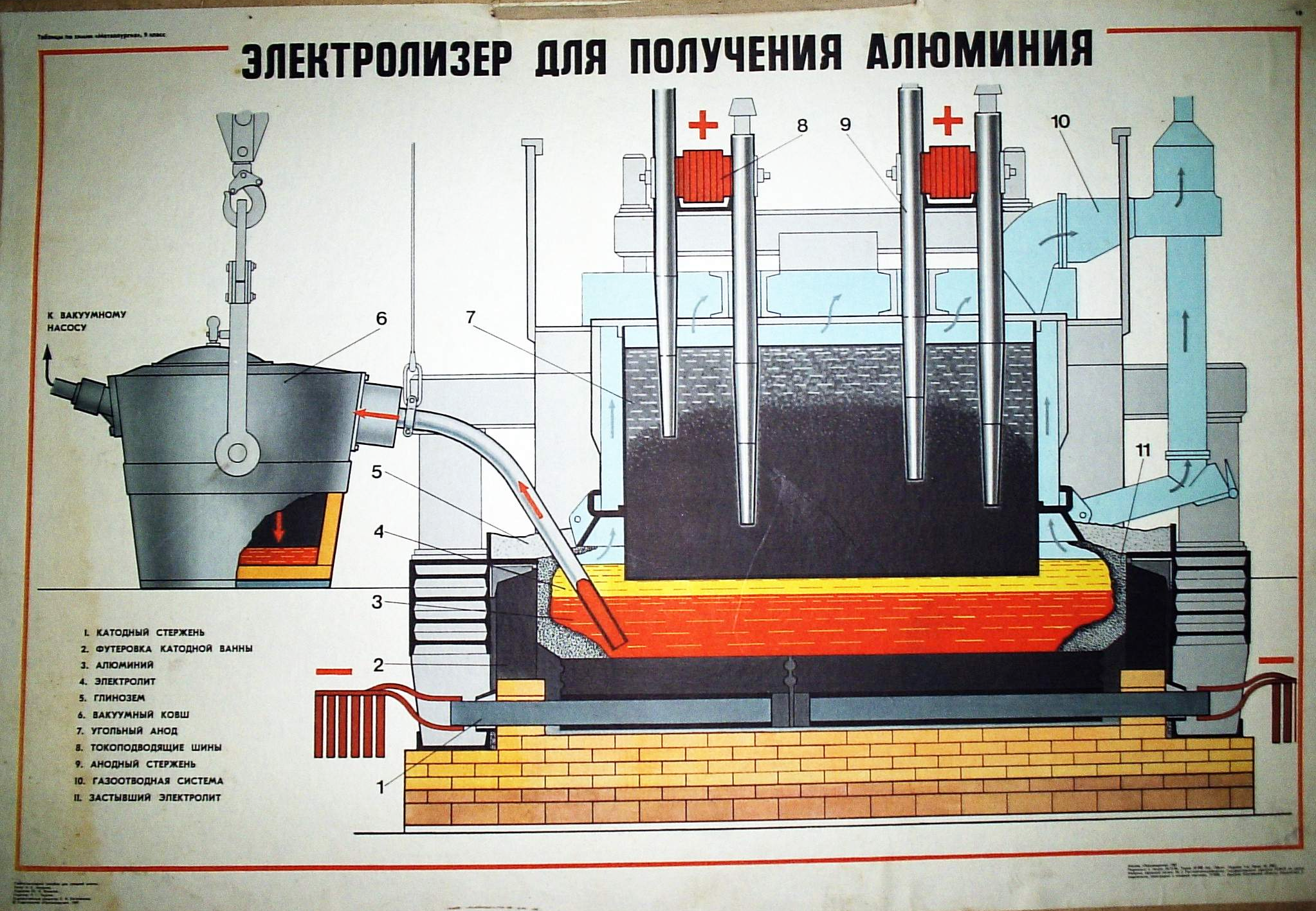
2.2 Розробка плану - конспекту уроку на тему «Алюміній як хімічний елемент і проста речовина. Фізичні та хімічні властивості алюмінію»
Амфотерні властивості алюміній оксиду і алюміній гідроксиду Мета:
- освітня: розширити й поглибити знання учнів про метали на прикладі Алюмінію – представника головної підгрупи ІІІ групи; розглянути фізичні й хімічні властивості Алюмінію; продовжити формувати в учнів уміння складати рівняння окисно-відновних реакцій.
- виховна: сформувати науковий світогляд учнів при вивченні фізичних та хімічних властивостей Алюмінію та його сполук, їх застосування; сприяти екологічному вихованню.
- розвиваюча:
1) розвивати спостережливість учнів на уроці хімії; 2) розвивати пізнавальний інтерес учнів до предмету; 3) розвивати навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей Алюмінію та його сполук; 4) розвивати такі мисленнєві операції : вміння порівнювати, узагальнювати, робити висновки; 5) розвивати такі мисленнєві операції : вміння порівнювати, узагальнювати, робити висновки. розвивати самостійність учнів під час виконання завдань.
Тип уроку: Урок засвоєння нових знань та вмінь.
Методи: загальні (ПІ), часткові (СНП), конкретні ( бесіда, розповідь).
Обладнання: періодична система хімічних елементів, таблиця розчинності, ряд активності металів, алюмінієвий дріт.
Література:
1) Хімія. 10 клас: Розробки уроків (рівень стандарту) / А.В. Промоскаль . – Х.: Вид-во «Ранок», 2011. – 272 с. 2) А.Т. Пилипенко, В.Я. Починок, И.П. Середа, Ф.Д. Шевченко. - Справочник по элементарной химии. / Под ред. Академика АН УССР А.Т. Пилипенко. – К.: Наукова думка. – 1985. 3) Хімія. 10 клас. Стандарт і академічний рівень / І.Ю. Старовойтова, О.В. Люсай. – Х.: Вид. група «Основа», 2010. – 79, [1]с. 4) Довідкові матеріали з хімії / І.І. Базелюк, Л.П. Величко, Н.В. Титаренко. – Київ; Ірпінь: ВТФ «Перун», 1998. – 224 с.
Хід уроку:
І. Актуалізація опорних знань:
1. Пригадайте, що таке металічний зв'язок? Що знаходиться у вузлах кристалічних ґраток у металів? 2. Пригадайте, які метали ви вивчали на попередніх уроках? Назвіть типові властивості цих металів? 3. Що таке амфотерність? 4. Охарактеризуйте положення Алюмінію в Періодичній системі хімічних елементів Д.І. Менделєєва. 5. Як ви думаєте, чи може Алюміній мати амфотерні властивості? ІІ. Мотивація навчальної діяльності учнів:
Одна легенда говорить, що одного разу до римського імператора Тиберія прийшов ювелір із металевою обідньою тарілкою, що не розбивається, виготовленою нібито з глини. Тарілка була дуже світлою й блищала, як срібло. За всіма ознаками вона мала бути алюмінієвою. При цьому ювелір стверджував, що тільки він і боги знають, як одержати цей метал з глини. Тиберій, побоюючись, що метал із легкодоступної глини може знецінити золото та срібло, і наказав, про всяк випадок, відрубати людині голову. Очевидно легенда досить сумнівна, тому що самородний Алюміній у природі не зустрічається через свою високу активність, і за часів Римської імперії не могло бути технічних засобів, які б дозволили здобути Алюміній із глинозему. Лише майже через 2000 років – у 1825 р. Ханс Християн Ерстед одержав кілька мг металічного Алюмінію.
Отже, сьогодні, як ви вже здогадалися мова йтиме за Алюміній. Отже, записуємо тему уроку: «Алюміній як хімічний елемент і проста речовина. Фізичні та хімічні властивості алюмінію. Амфотерні властивості алюміній оксиду і алюміній гідроксиду» Учні повинні:
- знати:фізичні й хімічні властивості Алюмінію та його сполук.
- вміти: складати рівняння хімічних реакцій на прикладі хімічних властивостей Алюмінію та його сполук. ІІІ. Вивчення нового матеріалу:
Положення в Періодичній системі. Учні характеризують положення Алюмінію у Періодичній системі хімічних елементів Д.І. Менделєєва. Будова атома Алюмінію.
Учні обговорюють будову атома Алюмінію. Також характеризують інші елементи цієї підгрупи, порівнюють їх з Алюмінієм.
Алюміній — метал III групи другого періоду в Періодичній системі хімічних елементів Д.І.Менделєєва. Алюміній у сполуках виявляє ступінь окиснення +3, так як має на зовнішньому енергетичному рівні 3 валентних електрони. Фізичні властивості Алюмінію: Алюміній – сріблясто-білий метал, легкий і пластичний, густина його = 2,7 г/см3, температура плавлення = 660 0С. Легко витягується в дріт, прокочується у фольгу. За електропровідністю поступається лише сріблу й міді. Входить до складу легких сплавів. Хімічні властивості лужних металів.
Одержують Алюміній електролізом Al2O3 у розплавленому кріоліті за температури близько 1000 0С. Взаємодія з неметалами:
1) З киснем: 4Аl + 3О2 = 2Аl2О3
2) З галогенами: 2Аl + ЗВr2 = 2АlВr3
3) З іншими неметалами при підвищенні температури:
2Аl + 3S = Аl2S3 (сульфід алюмінію) 2Аl + N2 = 2АlN (нітрид алюмінію) 4Аl + 3С = А14С3 (карбід алюмінію)
Алюмотермія: 2Аl + 3W3 = 3W + А12О3
Взаємодія з водою після зняття оксидної плівки:
2Аl + 6Н2О = 2Аl(ОН)3 + ЗН2
Після зняття оксидної плівки Алюміній розчиняється в лугах:
2Аl + 2NаОН + 2Н2О = 2NаАlО2 + 3Н2
Розчиняється в розведених кислотах:
2А1 + 6НС1 = 2АlСl3 + ЗН2
2А1 + ЗН2SО4 = Аl2(S04)3 + 3Н2
Алюміній пасивується при взаємодії з концентрованою нітратною кислотою, тому з нею Алюміній взаємодіє лише при нагріванні:
Аl + 6НNO3(конц.) = Аl(NО3)3 + 3NО2 + 3Н2О
