- •1. Механизм возникновения электродного потенциала
- •Гальванические элементы
- •Концентрационный гальванический элемент
- •Стандартный электродный потенциал
- •Окислительно-восстановительные потенциалы
- •Критерии самопроизвольного протекания ов реакций
- •Глубина протекания ов реакций
- •Ионоселективные электроды
- •Биологическое значение ов потенциалов
Критерии самопроизвольного протекания ов реакций
Известно, что если изменение свободной энергии Гиббса для реакции < 0, то она протекает в данном направлении самопроизвольно. Рассчет G для ОВР производится иначе (слайд)….

Для обратимых процессов -G =полезной работе
Для ОВР полезная работа- это электрическая работа ( работа, затрачиваемая на отрыв электронов от вещества при переводе его из восстановленной формы в окисленную) , которая рассчитывается по формуле….подставим… получим….
Из последнего уравнения видно, что возможность самопроизвольного протекания реакции между окислителем и восстановителем количественно оценивается по разности их потенциалов.
Е > 0 только в том случае, когда из более сильного окислителя или восстановителя, получаются более слабые окислители и восстановители. ОВ система, ОВ потенциал которой выше, всегда играет роль окислителя по отношению к окислительно-восстановительной системе, ОВ потенциал которой ниже. Например….(слайд)

Если в растворе несколько восстановителей и добавлен окислитель, то в первую очередь окислитель взаимодействует с самым сильным из них. Этот вывод важен для биологических систем.
Глубина протекания ов реакций
Константа равновесия характеризует глубину протекания процесса.
Например, в системе протекает химическая реакция: (слайд)

Ионоселективные электроды
Зависимость электродного потенциала от активной концентрации ионов, относительно которых обратим электрод, позволяет определить их равновесную концентрацию в растворе. Определение активности ионов методом измерения электродного потенциала называется ионометрией. Например, при измерении активности ионов вдорода можно пользоваться водородным электродом. Но это сложно технически! Поэтому применяют стеклянный электрод, т.к. его потенциал тоже зависит от активности ионов водорода в исследуемом растворе. СЭ представляет собой сосуд из очень тонкого электродного стекла (мембранное), заполненный 0,1 н р-ром HCl , в который помещен хлорсеребряный электрод. (слайд)

При погружении……Приведенное равновесие- равновесие Доннана, а потенциал- потенциал Доннана, его еще называют ионообменным потенциалом. Он возникает из-за различной концентрации ионов в ионообменнике (стекло) и исследуемом растворе. Схематически возникновение потенциалов в ГЭ из стеклянного электрода(индикаторного) и электрода сравнения (хлорсеребряного) можно представить так: (слайд)
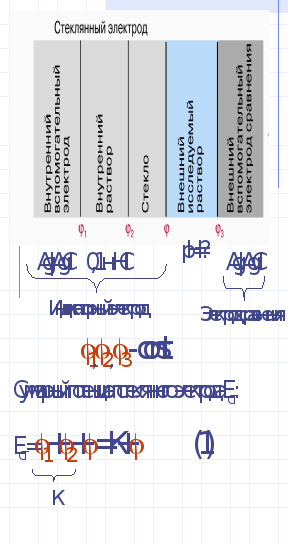
Применив полученные знания для расчета по уравнению Нернста, выведем формулу для расчета потенциала стеклянного электрода (Ест)
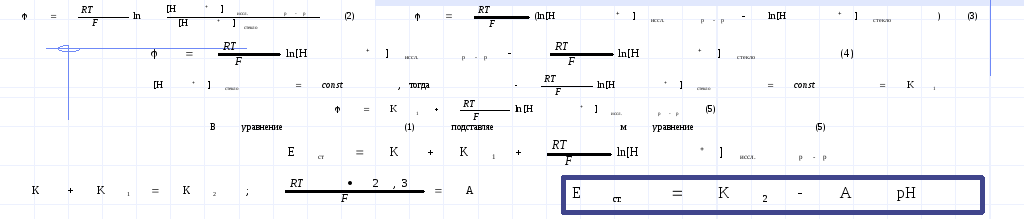
СЭ широко применяется для определения рН раствора

а ЭДС представленной цепи…..
Ецепи считывается с гальванометра в процессе эксперимента, К2 и А известные величины. Всегда можно определить рН исследуемого раствора. В универсальный иономерах шкала ЭДС имеет градуировку в единицах рН, т.е. с прибора сразу считывается значение рН исследуемого раствора.
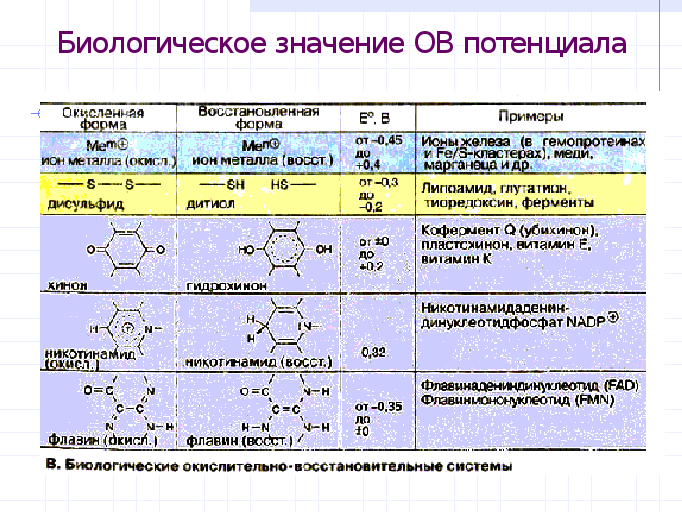
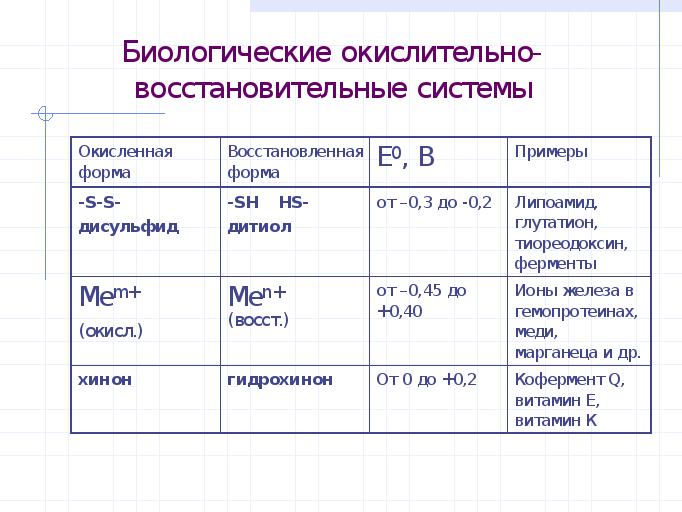
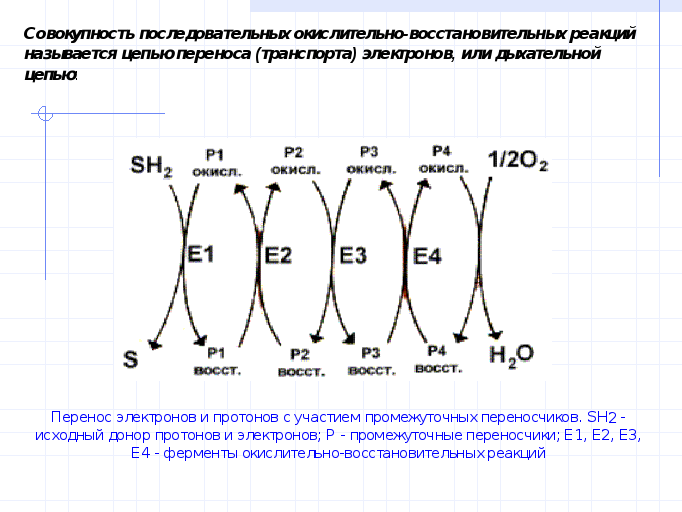
Биологическое значение ов потенциалов