
- •1. Механизм возникновения электродного потенциала
- •Гальванические элементы
- •Концентрационный гальванический элемент
- •Стандартный электродный потенциал
- •Окислительно-восстановительные потенциалы
- •Критерии самопроизвольного протекания ов реакций
- •Глубина протекания ов реакций
- •Ионоселективные электроды
- •Биологическое значение ов потенциалов
Концентрационный гальванический элемент
Концентрационным ГЭ называется ГЭ, состоящий из двух одинаковых электродов, помещенных в растворы одного и того же вещества различной концентрации. Это пример изометаллического ГЭ (слайд)
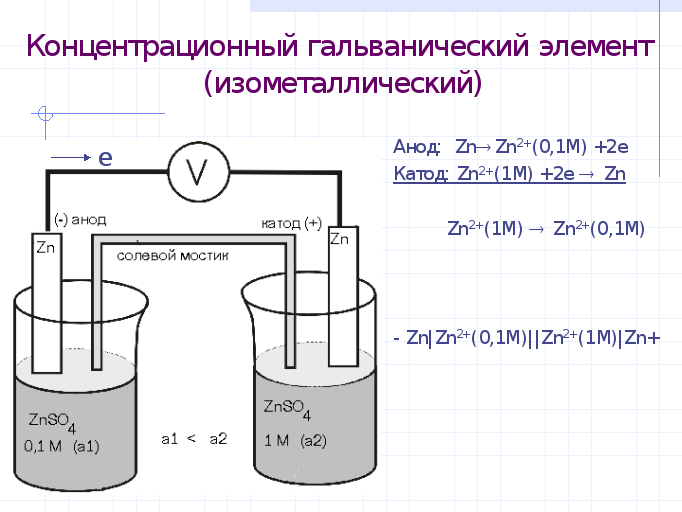
Отрицательное значение потенциала принимает тот электрод, который опущен в раствор с меньшей концентрацией. Положительное - тот, который опущен в р-р с большей концентрацией электролита. Источник энергии в таком ГЭ - работа по выравниванию концентраций. Он работает до тех пор, пока не выравняются концентрации солейв двух полуэлементах. ЭДС такого ГЭ рассчитывается так же-как разность потенциалов катода и анода. (слайд)
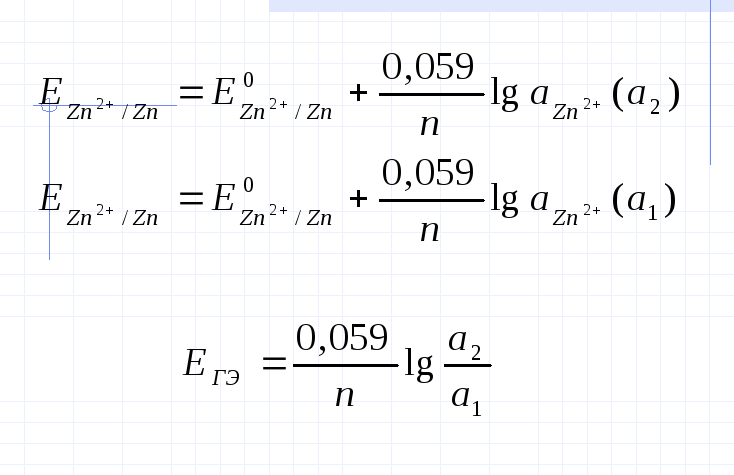
Стандартный электродный потенциал
Абсолютное значение потенциала электрода измерить нельзя. Поэтому потенциал какого либо электрода измеряют по отношению к такому электроду, потенциал которого известен (электроду сравнения). В качестве электрода сравнения используется нормальный водородный электрод, его потенциал условно принят за 0. Рассмотрим устройство НВЭ (слайд)


НВЭ состоит из платиновой пластинки, покрытой платиновой чернью (электролитически осажденная платина). Эта пластинка погружается в раствор 1М HCl и омывается струей водорода под давлением. Платиновая чернь адсорбирует на своей поверхности газообразный водород в атомарном состоянии. С определенным приближением можно сказать, что электрод сделан из водорода, который ведет себя как металл. На границе раздела фаз «платиновая чернь-раствор кислоты» устанавливается равновесие: (слайд)
Если пластинку металла, погруженного в раствор собственной соли, соединить электролитическим ключом с НВЭ, то получится ГЭ .ЭДС такого ГЭ элемента и есть стандартный электродный потенциал. Стандартный электродный потенциал обозначают Е0 Располагая металлы впорядке возрастания стандартных электродных потенциалов, получают ряд напряжения (слайд):
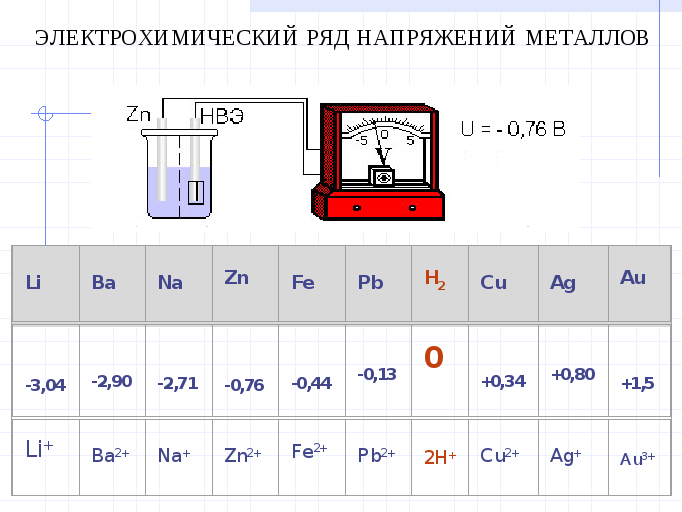
ЭРН справедлив для одномолярных р-ров солей при 250С
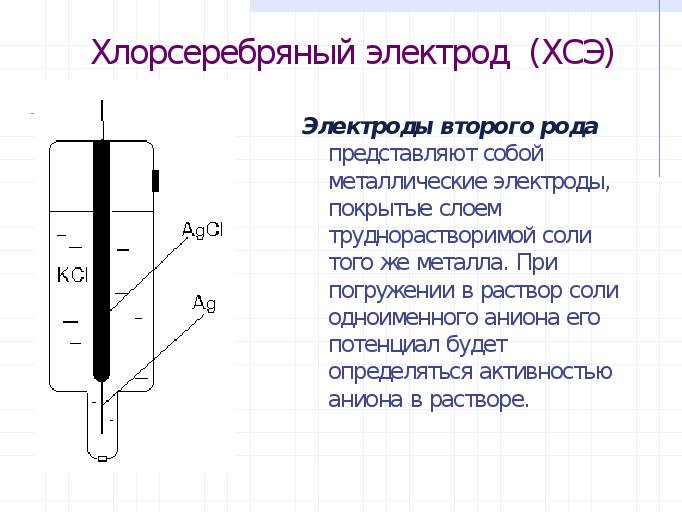
Кроме водородного электрода в качестве электрода сравнения используют широко хлорсеребряный электрод. Его потенциал является постоянным , но не равным 0. Он представляет собой серебряную проволоку, покрытую AgCl и помещенную в раствор, содержащий Cl-- ионы, например в р-р HCl (слайд):
Потенциал ХС электрода расчитывается следующим образом: (слайд)
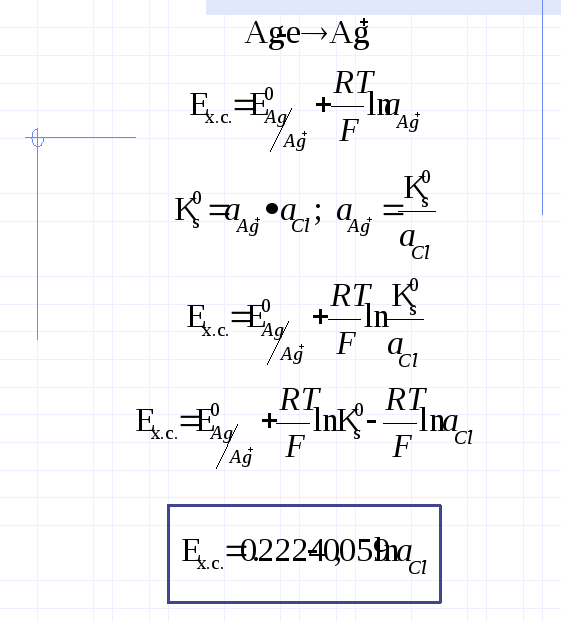
Потенциалопределяющей является реакция :
Ag -e Ag+
Уравнение Нернста для этого процесса следующее (слайд)………..
Однако, в присутствии труднорастворимой соли AgCl активность ионов серебра очень мала и ее трудно определить. Но активность ионов Ag+ связана с легко задаваемой в данной системе активностью Cl- через константу растворимости Ks (AgCl) (слайд)…………
При 250С равновесный потенциал ХС электрода определяется выражением: (слаид) ……………..Видно, что его потенциал определяется активностью ониона. Такие электроды называются электродами второго рода.
Окислительно-восстановительные потенциалы
Стандартный электродный потенциал любого металла является окислительно-восстановительным потенциалом. Однако, в химии принято называть ОВ потенциалом лишь те потенциалы, которые возникают на окислительно-восстановительных электродах. ОВ- электроды - это такие электроды, в которых материал электрода не изменяется, а лишь служит передатчиком электронов, получаемых или отдаваемых веществами, восстанавливающимися или окисляющимися на поверхности электродов.
Например, (слайд)
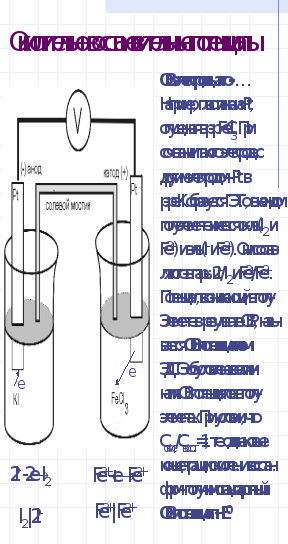

Рассчет ОВ потенциалов в реальных условиях производится по уравнению Н-П(слайд):

и приведенным образом для полуэлемента MnO4-/Mn2+. Видно, что величина ОВ потенциала зависит от…. (слайд )

Стандартные ОВ-потенциалы служат мерой окислительной и восстановительной способности веществ в реакции. Чем больше алгебраическая величина стандартного ОВ потенциала, тем больше его окислительные свойства.
