
Работа № 22. Линейчатые спектры.
1. Цель работы.
Целью данной работы является получение спектров испускания паров и газов, изучение закономерностей в спектре водорода и натрия.
2. вопросы, знание которых обязательно для допуска к выполнению работы.
- теория атома водорода по Бору.
- типы спектров испускания и их происхождение.
- квантовые числа. Связь энергии электрона и квантовых чисел.
- ход лучей в трехгранной призме.
- дисперсия света, нормальная дисперсия.
- угловая и линейная дисперсии призмы.
Часть 1.
Свет, благодаря которому мы зрительно воспринимаем окружающий мир, имеет сложный по длинам волн состав. Этот состав определяется природой вещества, которое его испускает и его состоянием, например, температурой. О степени сложности света можно судить на основании наблюдения его спектра. Спектры принято подразделять на линейчатые, полосатые и сплошные.
Линейчатые спектры получаются при разложении света испускаемого отдельными атомами или ионами раскаленных паров и газов. Эти спектры состоят из определенного числа тонких светлых линий.
Полосатые спектры испускания принадлежат молекулам и представляют собой совокупность широких полос, которые в свою очередь состоят из отдельных линий. Настолько мало отличающихся одна от другой по длине волны, что могут быть разрешены только самыми сильными спектральными приборами.
Сплошной спектр имеет свет, испускаемый раскаленными конденсированными системами – жидкостями и твердыми телами. Такой спектр представляет собой непрерывную полосу, содержащую все части видимого света от красного до фиолетового, т.е. свет всевозможных длин вон в этой области.
Закономерности в распределении спектральных линий в линейчатых спектрах сыграли большую роль в совпадении теории строения атома.
Часть 2.
Опытами резерфорда было
установлено, что атом любого химического
элемента состоит из положительно
заряженного ядра,
вокруг которого расположены отрицательно
заряженные электроны,
так что в целом атом нейтрален. Ядро, в
котором сосредоточена почти вся масса
атома занимает ничтожно малую часть
всего его объема. Диаметр
ядра порядка
![]() м
при размерах атома порядка
м
при размерах атома порядка
![]() м.
электроны согласно этой модели вращаются
вокруг ядра в первом приближении по
круговым орбитам.
м.
электроны согласно этой модели вращаются
вокруг ядра в первом приближении по
круговым орбитам.
Кулоновское взаимодействие между ядром и электроном играет роль центростремительной силы, равной для круговой орбиты:
![]() (1)
(1)
Электрон, находящийся в электрическом поле ядра, обладает потенциальной энергией:
![]() (2)
(2)
Полная энергия электрона равна сумме потенциальной и кинетической энергий
![]() (3)
(3)
Объединяя равенства (1) и (3), получим
![]() (4)
(4)
Согласно классической электродинамике, электрон, вращаясь по орбите, прерывно излучает энергию из формулы (4) следует, что меньшему значению энергии соответствует меньший радиус. В результате электрон должен упасть на ядро. В действительности этого не происходит. Выход из создавшегося положения был дан Бором.
Часть 3.
Для объяснения устойчивости атомов и наблюдаемых линейчатых спектров Бор сформулировал следующие постулаты:
1. Электрон в атоме может вращаться только строго по определенным – стационарным, орбитам, радиус которых определяется из условия
![]() (5)
(5)
Где
![]() – момент количества движения электрона,
– момент количества движения электрона,
![]() – постоянная Планка,
– постоянная Планка,
![]() число, определяющее принадлежность
электрона к той или иной орбите.
число, определяющее принадлежность
электрона к той или иной орбите.
2. вращаясь по стационарным орбитам электрон не излучает. Излучение происходит лишь при переходе электрона из стационарного состояния с большей энергией в другое состояние с меньшей энергией. При этом излучается квант света, частота которого определяется из условия:
![]() (6)
(6)
Где
![]() – энергия излучаемого кванта. Обратный
переход связан с поглощением энергии.
– энергия излучаемого кванта. Обратный
переход связан с поглощением энергии.
Вычислим радиусы стационарных орбит и полученную энергию электрона в водородоподобном атоме. Из (1) и (5) следует
![]() (7)
(7)
Подставляя полученное
значение
![]() в формулу (4) имеем
в формулу (4) имеем
![]() (8)
(8)
В общем случае
атомная система, состоящая из ядра и
одного электрона, переходя из состояния
с квантовым числом
![]() испускает согласно третьему постулату
Бора линии спектра с частотами
испускает согласно третьему постулату
Бора линии спектра с частотами
![]() (9)
(9)
Величина
![]() называется постоянной
Ридберга. Произведя
замену в (9) и переходя к длинам волн
получим:
называется постоянной
Ридберга. Произведя
замену в (9) и переходя к длинам волн
получим:
![]() (10)
(10)
Из формул (9) и (10) следует,
что все линии спектра могут быть
объединены в серии.
Серией называется совокупность линий
описываемых формулой (10), если
![]() ,
т.е. серии возникают при переходе
электрона с вышележащих орбит на орбиту
с данным квантовым числом
,
т.е. серии возникают при переходе
электрона с вышележащих орбит на орбиту
с данным квантовым числом
![]() .
.
Для водорода
![]() основными сериями являются:
основными сериями являются:
![]() – серия Лаймана
– серия Лаймана
![]() – серия Бальмера
– серия Бальмера
![]() – серия Пашена
– серия Пашена
![]() – серия Бреккета
– серия Бреккета
![]()
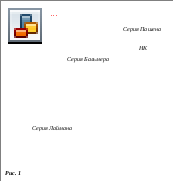 – серия Пфунда и т.д. (рис.
1).
– серия Пфунда и т.д. (рис.
1).
Некоторые серии спектра водорода, в частности Бальмера, были получены экспериментально задолго до создания теории Бора и послужили толчком в появлении Боровской теории водородоподобного атома.
