
§ 3. Изотермы реального газа
Определим вид изотерм Ван-дер-Ваальса. Для этого уравнение (7.2.5) перепишем в виде
![]() . (7.3.1)
. (7.3.1)
То есть уравнение Ван-дер-Ваальса есть уравнение третьей степени. Кубическое уравнение имеет три корня. В зависимости от соотношения между коэффициентами уравнения возможны следующие ситуации: один действительный и два мнимых корня; три действительных корня. В нашем случае уравнение разрешается относительно объема, мнимые корни, мнимые значения объема, не имеют физического смысла.
Действительные
корни уравнения могут быть либо все
равны, либо два равны между собой, либо
все три корня уравнения различны. Если
значение объема является корнем
уравнения, это означает, что при данном
значении объема линия
![]() пересекает изотерму. Таким образом,
когда все корни равны, линия
пересекает изотерму. Таким образом,
когда все корни равны, линия
![]() пересекает изотерму один раз, при двух
неравных корнях - два раза, а при трех -
три.
пересекает изотерму один раз, при двух
неравных корнях - два раза, а при трех -
три.
Построим изотерму реального газа. Запишем уравнение изотермы Ван-дер-Ваальса в явном виде:
![]() . (7.3.2)
. (7.3.2)
Исследуем поведение изотермы при высоких температурах (критерий деления температур на высокие и низкие будет определен ниже). В этом случае вторым слагаемым в (7.3.2) можно пренебречь, и уравнение (7.3.2) примет вид:
![]() , (7.3.3)
а изотермы реального газа будут
представлять собой гиперболы с асимптотами
, (7.3.3)
а изотермы реального газа будут
представлять собой гиперболы с асимптотами
![]() ,
(кривая 1 на рис. 7.3.1). Напомним, что для
изотерм идеального газа асимптотами
являются прямые
,
(кривая 1 на рис. 7.3.1). Напомним, что для
изотерм идеального газа асимптотами
являются прямые
![]() .
.
К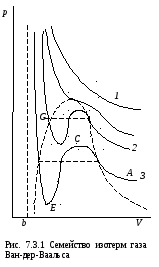 огда
температуры низкие, в зависимости от
объема реализуются различные случаи.
Для больших объемов мы вновь получим
гиперболу вида (7.3.3). При малых объемах,
можно пренебречь в (7.3.2) первым слагаемым
по сравнению со вторым и
огда
температуры низкие, в зависимости от
объема реализуются различные случаи.
Для больших объемов мы вновь получим
гиперболу вида (7.3.3). При малых объемах,
можно пренебречь в (7.3.2) первым слагаемым
по сравнению со вторым и
![]() .
Давление при малых объемах возрастает
быстрее, чем при больших.
.
Давление при малых объемах возрастает
быстрее, чем при больших.
При промежуточных объемах каждому значению давления соответствует три значения объема. Изотермы реального газа при низких температурах представлены на рис.7.3.1 (кривые 2,3).
§ 4. Метастабильные состояния
Из сравнения рис. 7.1.3. и рис. 7.3.1. видно, что изотермы реального газа существенно отличаются от экспериментальных изотерм Эндрюса. Сравнение будет проведено после анализа возможности реализации состояний на S-образном участке изотерм газа Ван-дер-Ваальса. Будем исходить из термодинамической устойчивости, как критерия оценки возможности или невозможности реализации состояний.
Необходимое условие термодинамической устойчивости состояния заключается в том, что при постоянной температуре с увеличением объема давление в системе должно уменьшаться, т.е. производная давления по объему при постоянной температуре должна быть меньше нуля:
![]() . (7.4.1)
. (7.4.1)
Рассмотрим изотерму газа Ван-дер-Ваальса (рис.7.3.1). Можно немедленно увидеть, что, в каждой точке участка CE изотермы, уменьшение объема сопровождается уменьшением давления, то есть необходимое условие устойчивости (7.4.1) не выполняется. Следовательно, состояния, изображаемые кривой CE неустойчивы, в них система не переходит, эти состояния не реализуются. На остальных участках изотермы реального газа необходимое условие устойчивости (7.4.1) выполнено. Итак, изотерма разбивается на две ветви: одна - AC - описывает поведение газа, другая - EG - поведение жидкости. На рис. 7.4.1 эти участки изображены сплошной линией.
Э кспериментальные
изотермы Эндрюса свидетельствуют о
существовании области параметров, при
которых пар и жидкость находятся в
состоянии динамического равновесия –
горизонтальный участок BF
на экспериментальной изотерме (рис.7.1.2),
соответствующий прямой BF
на рис. 7.4.1. Определим положение этого
участка относительно изотермы газа
Ван-дер-Ваальса.
кспериментальные
изотермы Эндрюса свидетельствуют о
существовании области параметров, при
которых пар и жидкость находятся в
состоянии динамического равновесия –
горизонтальный участок BF
на экспериментальной изотерме (рис.7.1.2),
соответствующий прямой BF
на рис. 7.4.1. Определим положение этого
участка относительно изотермы газа
Ван-дер-Ваальса.
Переход из состояния
B
в состояние F
можно осуществить двумя изотермическими
процессами, для которых
![]() .
Пусть эти процессы происходят обратимо.
Так как энтропия является функцией
состояния, то ее изменение в обоих этих
процессах одинаково
.
Пусть эти процессы происходят обратимо.
Так как энтропия является функцией
состояния, то ее изменение в обоих этих
процессах одинаково
![]() . (7.4.2)
. (7.4.2)
Из определения изменения энтропии в обратимом процессе
![]() . (7.4.3)
. (7.4.3)
Так как рассматриваются изотермические процессы, внутренняя энергия системы не изменяется, и из второго начала термодинамики следует
![]() , (7.4.4)
, (7.4.4)
![]() . (7.4.5)
. (7.4.5)
Первый интеграл в (7.4.5) численно равен площади под BF , а второй - площади под кривой BCDEF. Равенство этих площадей возможно только тогда, когда площадь фигуры BCD равна площади фигуры FDE. Итак, участок расположен таким образом, что площади этих фигур одинаковы.
Вернемся к
сопоставлению экспериментальных и
модельных изотерм. Устойчивыми состояниями
в диапазоне объемов
![]() являются состояния динамического
равновесия жидкости и ее пара (состояния
на прямой BF).
Могут ли реализовываться на практике
состояния BC
и EF?
Эти состояния, очевидно, менее устойчивы,
чем состояние динамического равновесия,
т.е. при небольших внешних воздействиях
или внутренних флуктуациях, система
переходит в состояние устойчивого
равновесия (переход LM).
Такие состояния являются метастабильными.
Соответствующие состояния можно
наблюдать. Рассмотрим подробнее, условия,
при которых могут быть осуществлены
метастабильные состояния. Начнем с
пересыщенного газа.
являются состояния динамического
равновесия жидкости и ее пара (состояния
на прямой BF).
Могут ли реализовываться на практике
состояния BC
и EF?
Эти состояния, очевидно, менее устойчивы,
чем состояние динамического равновесия,
т.е. при небольших внешних воздействиях
или внутренних флуктуациях, система
переходит в состояние устойчивого
равновесия (переход LM).
Такие состояния являются метастабильными.
Соответствующие состояния можно
наблюдать. Рассмотрим подробнее, условия,
при которых могут быть осуществлены
метастабильные состояния. Начнем с
пересыщенного газа.
Пусть изотермически
сжимается газ, в котором отсутствуют
неоднородности, например, капли жидкости,
частички пыли и т.д., то есть центры
конденсации. Такой газ может пройти в
состояния, изображаемые участком BC,
и называется переохлажденным
паром (или
пересыщенным
газом).
Следует различать состояния,
характеризующиеся понятиями газ и пар:
при
![]() - пар, а при
- пар, а при
![]() -газ.
-газ.
Для образования
капельки (при конденсации) необходимо,
чтобы большое количество молекул газа
одновременно сблизились до расстояния,
соизмеримого с расстоянием молекул в
жидкости. Вероятность такого явления
чрезвычайно мала и, чтобы ее увеличить,
в систему вводят так называемые центры
конденсации (пылинки, капельки жидкости,
ионы и т.д.), которые улавливают подлетающие
к ним молекулы и переводят их в
конденсированную фазу. На практике газ
всегда содержит большое количество
центров конденсации, и процесс
преобразования газа в жидкость идет
легко. Если же газ очистить, то вероятность
существования пересыщенного газа
возрастает. Следует отметить, что даже
в очищенном состоянии в газе появляются
центры конденсации в виде ионов этого
же газа, которые возникают из-за действия
космических лучей или естественного
радиоактивного фона. Последнее
обстоятельство используется для
регистрации и изучения заряженных
частиц (продуктов радиоактивного распада
или космических лучей) в камере Вильсона.
Пересыщенный газ в камере Вильсона
достигается путем адиабатического
расширения непересыщенного, т.е. обычного
газа. Поскольку адиабата круче изотермы,
то можно из области стабильного состояния
при
![]() перейти в область метастабильного
состояния при
перейти в область метастабильного
состояния при
![]() (
(![]() ).
).
Влетевшая в камеру Вильсона заряженная частица на своем пути ионизирует молекулы газа (обычно пары спирта), образуя центры конденсации. Пересыщенный газ, конденсируясь на возникших ионах мелкие капельки, образует хорошо видимый след - трек. Фотографируя треки частиц в различных магнитных полях, можно установить заряд и массу этих частиц.
Если, по каким-либо причинам в системе возникают центры конденсации (например, в состоянии L, рис. 7.4.1), система скачком переходит в состояние M. Часть пара конденсируется, и в системе устанавливается динамическое равновесие.
При определенных условиях удается наблюдать и состояния, изображаемые участком EF, перегретую жидкость. Рассмотрим условия получения перегретой жидкости. Процесс кипения в обычной жидкости происходит на так называемых центрах кипения, роль которых выполняют инородные включения, а также пузырьки растворенного в жидкости газа, которые могут быть устранены путем длительного кипячения. Если такая жидкость предварительно тщательно очищена, то она может быть путем нагревания (при р = const) переведена в перегретое состояние (участок FE, рис. 7.4.1) Это возможно осуществить также при изотермическом расширении жидкости, в которой отсутствуют неоднородности, например растворенные газы. Появление центров парообразования приводит к скачкообразному переходу в состояние с тем же объемом и давлением, соответствующим участку BF, и в системе устанавливается динамическое равновесие между жидкостью и ее паром. Если в перегретую жидкость бросить песчинку, то она бурно вскипит.
П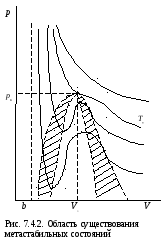 оявление
центров парообразования может быть
связано как с внешними факторами
(попадание в жидкость каких-либо мелких
частиц), так и с процессами в самой
системе. Полностью очистить жидкость
от растворенных в ней газов невозможно,
в жидкости всегда присутствуют молекулы
газа. Эти молекулы движутся в жидкости,
встреча нескольких молекул и обусловит
появление центра парообразования. Место
и время их встречи определяется
вероятностным образом, т.е. каждое
метастабильное состояние является
точкой бифуркации (точкой, в которой
поведение системы определяется
вероятностными закономерностями), после
прохождения которой возможны два исхода:
новое метастабильное состояние или
состояние динамического равновесия.
оявление
центров парообразования может быть
связано как с внешними факторами
(попадание в жидкость каких-либо мелких
частиц), так и с процессами в самой
системе. Полностью очистить жидкость
от растворенных в ней газов невозможно,
в жидкости всегда присутствуют молекулы
газа. Эти молекулы движутся в жидкости,
встреча нескольких молекул и обусловит
появление центра парообразования. Место
и время их встречи определяется
вероятностным образом, т.е. каждое
метастабильное состояние является
точкой бифуркации (точкой, в которой
поведение системы определяется
вероятностными закономерностями), после
прохождения которой возможны два исхода:
новое метастабильное состояние или
состояние динамического равновесия.
Перегретую жидкость также используют для регистрации и исследования заряженных частиц в пузырьковых камерах Глейзера.
На рис. 7.4.2. Показана область существования метастабильных состояний (заштрихованные области).
