
- •Физика. Экзамен.
- •1) Кинематика материальной точки, Основная задача кинематики, три способа геометрического описания движения материальной точки. Кинематическое уравнение движения материальной точки.
- •2) Кинематические характеристики движения точки: скорость и ускорение. Нормальное и тангенциальное ускорение материальной точки.
- •3) Кинематика вращательного движения абсолютно твёрдого тела. Угловая скорость и угловое ускорение, их связь с линейной скоростью и линейным ускорением точек вращающегося тела.
- •4) Динамика поступательного движения материальной точки. Законы Ньютона.
- •5) Динамика материальной точки. Основные уравнения движения материальной точки в дифференциальной форме.
- •6) Динамика системы частиц, центр инерции системы, закон движения центра инерции.
- •7) Динамика системы частиц, закон сохранения импульса в замкнутой системе.
- •8) Динамика переменной массы. Уравнение движения тела переменной массы. Уравнение Циолковского.
- •9) Механическая энергия и работа. Работа переменной силы. Мощность. Работа консервативных сил.
- •15) Динамика вращательного движения тела. Основной закон динамики вращательного движения тела относительно неподвижной оси вращения.
- •16) Динамика вращательного движения тела. Момент импульса, закон сохранения момента импульса.
- •17) Гармонические колебания и их характеристики. Дифференциальное уравнение свободных колебаний.
- •18) Механические гармонические колебания; пружинный, физический и математический маятники.
- •19) Энергия гармонических колебаний. Закон сохранения энергии свободных гармонических колебаний.
- •20) Затухающие колебания, дифференциальное уравнение затухающих колебаний. Логарифмический декремент затухания.
- •21) Механические волны. Уравнение бегущей волны. Фазовая скорость.
- •22) Статистический и термодинамический методы исследования макроскопических свойств системы. Термодинамические параметры, равновесные состояния и процессы. Уравнение состояния системы.
- •Состояние оценивается параметрами: температура, плотность, давление, объем.
- •23) Опытные законы идеальных газов.
- •24) Основное уравнение молекулярно-кинетической теории газов.
- •25) Закон распределение Максвелла по скоростям теплового движения молекул.
- •26) Барометрическая формула. Распределение Больцмана во внешнем потенциальном поле.
- •27) Основы термодинамики: внутренняя энергия, число степеней свободы. Закон равномерного распределения энергии по степеням свободы.
- •28) Первое начало термодинамики. Работа газа при изменении его объёма. Теплоёмкость газа.
- •29) Первое начало термодинамики. Применения первого начала термодинамики к изопроцессам.
- •30) Реальные газы. Уравнение Ван-дер-Вальса.
- •31) Обратимые и необратимые процессы. Круговой процесс. Термический кпд цикла.
- •32) Тепловые двигатели. Цикл Карно и его кпд для идеального газа.
- •33) Энтропия, её связь между термодинамической вероятностью. Свойства энтропии. Второе и третье начала термодинамики.
- •34) Электрический заряд. Законы сохранения и квантования заряда. Взаимодействие электрических зарядов. Закон Кулона.
- •35) Электрическое поле. Напряжённость электрического поля. Напряжённость поля точечного заряда. Принцип суперпозиций полей. Графическое изображение поля.
- •36) Поток вектора напряжённости электрического поля. Теорема Остроградского-Гаусса.
- •37) Расчёт напряжённости электрических полей, созданных равномерно заряженной плоскостью, объёмно заряженным шаром, заряженной сферой.
- •38) Работа сил электрического поля при перемещении заряда. Циркуляция вектора напряжённости электрического поля.
- •39) Потенциал электростатического поля. Разность потенциалов.
- •40) Связь между напряжённостью и разностью потенциалов. Напряжённость, как градиент потенциала. Эквипотенциальные поверхности.
30) Реальные газы. Уравнение Ван-дер-Вальса.
Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:
![]()
где
-
p — давление,
-
V — объём,
-
T — абсолютная температура,
-
R — универсальная газовая постоянная.
Видно, что это уравнение фактически является уравнением состояния идеального газа с двумя поправками. Поправка a учитывает силы притяжения между молекулами (давление на стенку уменьшается, т.к. есть силы, втягивающие молекулы приграничного слоя внутрь), поправка b — силы отталкивания (из общего объёма вычитаем объём, занимаемый молекулами).
Для ν молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
![]()
31) Обратимые и необратимые процессы. Круговой процесс. Термический кпд цикла.
Обратимый процесс (то есть равновесный) — термодинамический процесс, который может проходить как в прямом, так и в обратном направлении.
Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния. Все реальные процессы необратимы. Реальные процессы сопровождаются с потерей энергии.
Круговой процесс (цикл) – процесс, который, пройдя ряд состояний, возвращается в исходное.
Термический КПД цикла:
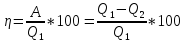
32) Тепловые двигатели. Цикл Карно и его кпд для идеального газа.
Теплово́й дви́гатель — тепловая машина, превращающая тепло в механическую энергию.
Цикл Карно́ — идеальный термодинамический цикл. Тепловая машина Карно, работающая по этому циклу, обладает максимальным КПД.
Основная задача – превращение тепла в работу.
Цикл Карно состоит из четырёх стадий:
-
Изотермическое расширение (1→2).
-
Адиабатическое (изоэнтропическое) расширение (2→3).
-
Изотермическое сжатие (3→4).

-
Адиабатическое (изоэнтропическое) сжатие (4→1)
Коэффициент полезного действия
тепловой машины Карно равен:
![]() .
.
33) Энтропия, её связь между термодинамической вероятностью. Свойства энтропии. Второе и третье начала термодинамики.
Энтропия - мера вероятности осуществления какого-либо макроскопического состояния.
Всякое макросостояние может быть осуществлено различными способами, каждому из которых соответствует некоторое микросостояние системы.
Термодинамическая вероятность ωi – число микросостояний, соответствующих данному i-му состоянию макросистемы.
Отношение ωi к полному числу возможных микросостояний макросистемы называют вероятностью (математической) i-ого состояния:
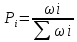
Энтропия характеризует вероятность состояния системы:
S=k*ln ω, где k – постоянная Больцмана.
Свойства:
-
Энтропия является функцией состояния, т.к. зависит только от начальных и конечных параметров состояния системы и не зависит от пути протекания процесса.
-
Энтропия определяется с точностью до произвольной постоянной.
-
Энтропия S системы, состоящей из n частей, равна алгебраической сумме энтропий Si каждой части:

-
В теплоизолированной системе при протекании обратимого процесса энтропия не меняется.
-
При постоянном объёме энтропия является непрерывно возрастающей функцией внутренней энергии системы.
-
Энтропия замкнутой теплоизолированной системы всегда возрастает.
Второе начало термодинамики:
Невозможен процесс, единственным результатом которого является передача теплоты от тёплого к холодному. (Р. Клаузиус)
Невозможен процесс, единственным результатом которого является совершение работы за счёт охлаждения одного тела. (У. Томсон)
В макроскопической замкнутой системе процессы протекают таким образом, что вероятность конечного состояния не может быть меньше вероятности начального состояния. (Л. Больцман)
Третье начала термодинамики:
При стремлении к 0 температуры тела энтропия его также стремится к 0.
