
Тесты из задачника 989898FF
.pdf86. Ферменты с аллостерической регуляцией, как правило: |
Б, Г, Д. |
А. Являются белками с третичной структурой организации; |
|
Б. Являются олигомерными белками; |
|
В. Ингибируются необратимо; |
|
Г. Имеют активные и аллостерические центры, расположенные в разных |
|
протомерах; |
|
Д. Аллостерическими эффекторами являются метаболиты этого |
|
метаболического пути. |
|
87. Регуляция ферментов с помощью частичного протеолиза включает: |
А, Б, В, |
А. Изменение первичной структуры фермента; |
|
Б. Изменение вторичной и третичной структуры фермента; |
|
В. Необратимую активацию; |
|
Г. Необратимое ингибирование; |
|
Д. Формирование активного центра. |
|
88. Регуляция активности ферментов с помощью белокбелковых |
Б, В. |
взаимодействий сопровождается: |
|
А. Необратимым ингибированием; |
|
Б. Присоединением или отщеплением регуляторных белковых |
|
субъединиц; |
|
В. Присоединением или отщеплением белковрегуляторов; |
|
Г. Фосфорилированием фермента; |
|
Д. Дефосфорилированием фермента. |
|
89. Аллостерические ферменты: |
А, Б, Г, |
А. Катализируют скорость лимитирующие реакции; |
|
Б. Расположены вначале метаболического пути; |
|
В. Редко встречаются в клетке ; |
|
Г. Катализируют необратимые реакции; |
|
Д. Катализируют реакции в месте разветвления метаболического пути. |
|
90. Изменение активности ферментов по механизму фосфорилирования |
Б, Г. |
дефосфорилирование обеспечивают следующие ферменты: |
|
А. Сукцинатдегидрогеназа; |
|
Б. Фосфопротеинфосфатаза; |
|
В. Глюкокиназа; |
|
Г. Протенкиназа; |
|
Д. Аденилатциклаза. |
|
91. Активация ферментов в клетке путем фосфорилирования: |
А, Б, Г. |
А. Зависит от концентрации ряда гормонов в крови; |
|
|
|
|
|
Б. Происходит с участием АТФ; |
|
В. Сопровождается изменением аминокислотного состава ферментов; Г. |
|
Вызвана активацией протеинкиназ; |
|
Д. Необратимый для клетки процесс. |
|
92. Активация ферментов в клетке путем фосфорилирования: |
А, В, Д. |
А. Это является ответом клетки на изменение концентрации ряда |
|
гормонов в крови; |
|
Б. Сопровождается диссоциацией субъединиц фермента; |
|
В. Происходит с участием АТФ; |
|
Г. Необратимый процесс ковалентной модификации фермента; |
|
Д. Происходит после присоединения цАМФ к протеинкиназе А. |
|
93. Фермент протеинкиназа А: |
А, В |
А. Олигомерный белок; |
|
Б. Мономерный белок; |
|
В. Активируется ц АМФ; |
|
Г. Является холоферментом; |
|
Д. Подвергается активации по механизму белок-белковых взаимодействий. |
|
94. Фермент протеинкиназа А: |
А,Б, В, |
А. Активируется ц АМФ; |
|
Б. Изменяет конформацию при действии на клетку кофеина и |
|
теофиллина; |
|
В. Может уменьшить активность при участии фосфодиэстеразы; |
|
Г. Активная форма – олигомерный белок R2C2; |
|
Д. Активная форма – каталитическая субъединица С. |
|
95.Фермент креатинкиназа: |
Б, В |
А. Мономерный белок; |
|
Б. Олигомерный белок; |
|
В. Используется для диагностики инфаркта миокарда; |
|
Г. Используется для диагностики гепатита; |
|
Д. Относится к классу лиаз. |
|
|
|
96. Фермент аспарагиназа: |
А,Г |
А. Уменьшает концентрацию аспарагина в крови; |
|
Б. Увеличивает концентрацию аспарагина в крови; |
|
В. Уменьшает синтез белков во всех клетках организма; |
|
Г. Уменьшает синтез белков в лейкозных клетках; |
|
Д. Уменьшает концентрацию аспарагиновой кислоты в крови. |
|
97. Фермент лактатдегидрогеназа: |
А, Б, Г, |
А. Олигомерный белок; |
|
Б. Используется для диагностики инфаркта миокарда; |
|
В. Используется для диагностики гепатита; |
|
Г. В разных тканях используются разные изоферменты; |
|
Д. Относится к классу оксидоредуктаз. |
|
98. Использование ферментов в медицине возможно: |
А, Б, Д. |
А. В качестве лекарственных препаратов; |
|
Б. Для диагностики заболеваний; |
|
В. Для коррекции заболеваний, связанных с нарушениями функционирования |
|
ферментов; |
|
Г. Для лечения миастений. |
|
Д. В качестве аналитических реактивов. |
|
99. Введение аспарагиназы в кровь больных лейкозом изменяет: |
А, Б, Д. |
А. Концентрацию аспарагина в крови; |
|
Б. Синтез белков в лейкозных клетках; |
|
В. Синтез белков во всех клетках организма; Г. |
|
Синтез аспарагина в лейкозных клетках; |
|
Д. Концентрацию аспартата в крови. |
|
100. Использование протеолитических ферментов в медицине, возможно для: |
В, Д |
А. В лечении злокачественных заболеваний; |
|
Б. В аппаратах «искусственная почка» для разрушения мочевины; |
|
|
|
|
|
В. Для очистки ран; |
|
Г. Для рассасывания рубцов; |
|
Д. В качестве заместительной терапии при нарушении пищеварения; |
|
|
|
|
|
101. Определение активности ферментов в крови используется: |
Б, В, Д. |
А. Для диагностики наследственных энзимопатий; Б. Для |
|
постановки диагноза заболеваний; В. Для контроля |
|
эффективности лечения ряда заболеваний; Г. При |
|
воспалительных заболеваниях органов дыхания; |
|
Д. При воспалительных процессах печени. |
|
|
|
102. Для энзимодиагностики инфаркта миокарда используют ферменты: |
Б, Г, Д. |
А. Сукцинатдегидрогеназа; |
|
Б. Лактатдегидрогеназа; |
|
В. Гиалуронидаза; |
|
Г. Креатинкиназа; |
|
Д. Аминотрансферазы. |
|
103. Принципы энзимодиагностики основаны на: |
А, Б, Г, |
А. Выходе ферментов в кровь при повреждении тканей; |
|
Б. Органоспецифичности; |
|
В. Высокой стабильности ферментов; |
|
Г. Преобладании определенных изоферментов в разных тканях; |
|
Д. Низкой активности или полном отсутствии активности ферментов в |
|
норме в крови. |
|
104. Наследственые энзимопатии связаны с такими изменениями первичной |
А, В, Д. |
структуры ферментов, при которых может произойти: |
|
А. Нарушение сродства активного центра к субстрату; |
|
Б. Увеличение активности фермента; |
|
В. Изменение концентрации метаболитов в |
|
клетке; Г. Увеличение количества фермента в клетке; |
|
Д. Уменьшение активности фермента. |
|
|
|
105. Нуклеазы используются в медицине, потому что они: |
А, В, Д. |
|
|
А. Инактивируют ДНК-содержащие вирусы; |
|
Б. Вызывают гибель бактерий; |
|
В. Эффективны при вирусных конъюнктивитах; |
|
Г. Эффективны при вирусных гепатитах; |
|
Д. Эффективны при ринитах. |
|
106. |
1-Б; 2-Г; |
1. Абсолютная субстратная специфичность |
|
2. Относительная субстратная специфичность |
|
3. Каталитическая специфичность |
|
3-А. Предусматривает превращение субстрата по одному из путей |
|
превращения |
|
1-Б. Предусматривает взаимодействие фермента только с одним |
|
субстратом В. Предусматривает несколько разных превращений одного и |
|
того же субстрата |
|
2-Г. Предусматривает взаимодействие фермента с группой подобных |
|
субстратов |
|
Д. Предусматривает взаимодействие только с одним из стереоизомеров для |
|
данного вещества |
|
|
|
107. |
1-Б; 2-А |
Кофермент |
|
1. Пиридоксальфосфат |
|
2. Кофермент A (HSКoA) |
|
3. NAD |
|
Фермент |
|
2-А. Ацилтраисфераза |
|
1-Б. Аминотрансфераза |
|
В.Декарбокснлаза |
|
3-Г. Дегидрогеназа |
|
Д. Карбоксилаза кетокислот |
|
|
|
108. |
1-В; 2-Г; 3-Б. |
Кофермент |
|
1. Тиаминдифосфат |
|
2. ФАД |
|
3. Пиридоксальфосфат |
|
Фермент |
|
А. Ацилтрансфераза |
|
3-Б. Декарбоксилаза аминокислот |
|
1-В. Декарбоксилаза кетокислот |
|
2-Г. Дегидрогеназа |
|
Д. Карбоксилаза |
|
109. |
1-Г; 2-Д; 3-А. |
Кофермент |
|
1. NAD |
|
2. FAD |
|
3. КоферментА (HSKoA) |
|
Витамин |
|
3-А. Пантотеновая кислота. |
|
Б. В6 |
|
В. Ннкотинамид |
|
1-Г. Биотип |
|
2-Д. В2 |
|
110. |
1-Б; 2-В; 3-Д. |
Кофермент |
|
1. Пиридоксальфосфат |
|
2. Тиаминдифосфат |
|
3. Биотии |
|
Фермент |
|
А. Дегидрогеназа |
|
1-Б. Амннотрансфераза |
|
2-В. Декарбокснлаза кетокислот |
|
Г. Ацитилтрансфера 3-Д. |
|
Карбоксилаза |
|
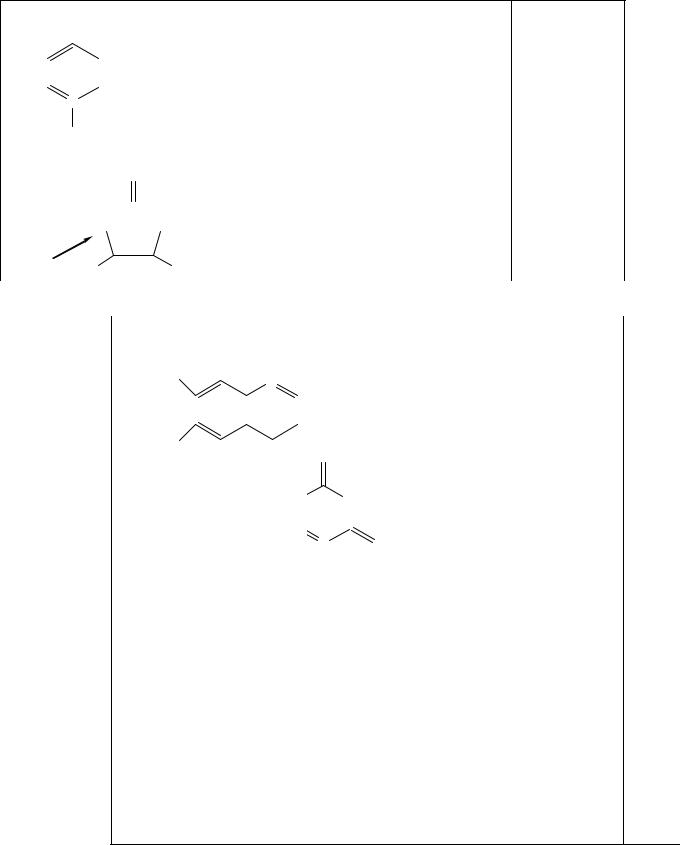
111. |
|
|
|
1-Г; 2-В; 3-Б. |
|
|
|
|
Кофермент: |
|
1. |
|||
|
|
|
|
CONH2 |
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
N |
|||
|
|
|
|
R |
 C
C
HN NH
NH
|
2. |
O |
|||||||
|
|
|
|
|
|
|
|
|
|
|
CO2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. |
|
|||||
|
H3C |
|
N |
||||||
|
|
|
|
||||||
|
|
|
|
|
|
|
|
O H |
|
|
|
|
|
|
|
|
|
||
|
3C |
|
|
O |
|||||
|
Активная группа |
|
|
|
|
|
NH |
||
|
|
|
|
|
|||||
|
А. B1 |
|
|
|
|
|
|
|
|
|
3-Б. B2 |
|
|
N |
|||||
|
2-В. PP |
|
|
||||||
|
|
|
|
|
|
|
|
||
|
1-Г. Биотин |
|
|
|
|
|
|
|
|
|
Д. Пантотеновая кислота |
||||||||
|
|
|
|
|
|
|
|
|
|
|
112. |
|
|
|
|
|
|
|
1-Б; 2-Д |
|
Класс фермента: |
1. |
|
|
|
|
|
||
Оксидоредуктазы
2.Лигазы
3.Трансферазы
Подкласс:
3-А. Киназы
1-Б. Дегидрогеназы
В. Гидроксилазы Г. Фосфатазы
2-Д. Карбоксилазы
113. |
1-Б; 2-А |
Формула активности |
|
1.1мкмоль превращенного субстрата 1мин
2.1моль превращенного субстрата 1с
3.Количество превращенного субстрата (мкмоль) Время (мин) *
количество белка (мг)
Активность фермента 2-А.
Катал.
1-Б. Единица активности (ME).
3-В.Удельная активность. Г.
Количество каталов.
Д. Количество единиц активности.
3. NH CHR
CHR CO
CO NH
NH CHR
CHR CO
CO
А. Оксидоредуктаза Б. Трансфераза
2-В. Изомераза
1,3-Г. Гидролаза
Д. Лигаза

115. |
|
|
|
|
|
Глюкозо-6-фосфат + АДФ |
Ответ: 1 |
||
Катализирует реакцию: |
3-Г. |
||||||||
|
|||||||||
1. |
|
COOH CH3 |
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
||||
C O + CO2 + ÀÒÔ + H2O C O |
|
|
|
|
2 Глюкоза |
|
|||
|
|
|
|
|
|||||
COOH |
|
COOH |
|
|
|
|
|||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. |
|
Глюкоза + |
АТФ + H2O |
|
|
||||
3.Глюкоза-Глюкоза (Мальтоза) + H2O
А. Оксидоредуктаза |
|
|
2-Б. Трансфераза |
|
|
В. Изомераза |
|
|
3-Г. Гидролаза |
|
|
1-Д. Лигаза |
|
|
|
|
|
116. Установите соответствие: |
Свойства лекарственного вещества: |
1-Г; 2-Б |
Лекарственное вещество: |
А. Структурный аналог |
|
|
парааминобензойной килоты; |
|
1. Прозерин |
2-Б. Ингибитор фосфодиэстеразы; |
|
2. Теофиллин |
|
|
В. Ингибитор ксантиноксидазы; 1-Г. |
|
|
3. Аспирин |
|
|
Структурный аналог |
|
|
|
|
|
|
ацетилхолина; |
|
|
3-Д. Является необратимым |
|
|
ингибитором |
|
|
|
|
117. Установите соответствие: |
|
1-А; 2-Д |
Механизм ингибирования: |
Свойства ингибитора: |
|
|
|
|
1. Конкурентный ингибитор |
А. Является структурным аналогом |
|
|
|
|
2. Неконкурентный ингибитор |
субстрата; |
|
3. Специфический необратимый |
Б. Взаимодействует с ОНгруппами сер |
|
ингибитор |
активного центра; |
|
|
В. Является структурным аналогом |
|
|
продукта; |
|
|
Г. Является структурным аналогом |
|
|
кофермента; |
|
|
Д. Взаимодействует с ферментом в месте |
|
|
отличным от активного центра. |
|
118. Установите соответствие: |
|
1-В; 2-Б |
Лекарственное вещество: |
Применение при заболевании: |
|
|
1.Сульфаниламидные препараты |
А. Инфаркт миокарда. |
|
|
2.Аллопуринол |
Б. Подагра; |
|
|
3.Трасилол |
В. Инфекционные (микробные); |
|
|
|
Г. Панкреатит; |
|
|
|
Д. Гепатит. |
|
|
119. Регулировать активность ферментов можно: |
|
А, Б, В. |
|
А. С помощью аллостерического лиганда; |
|
|
|
Б. Путем фосфорилирования/дефосфорилирования; |
В. |
|
|
Специфическим гидролизом пептидных связей; Г. С |
|
|
|
помощью лекарственных веществ – ингибиторов Д. С |
|
||
помощью токсинов. |
|
|
|
|
|
|
|
Раздел дисциплины (тема): матричные биосинтезы.
Вопрос |
Ответ |
|
|
1. Формирование вторичной структуры ДНК происходит за счет: |
А |
А. Водородных связей |
|
Б. Ионных связей |
|
B. Сложноэфирных связей |
|
Г. Дисульфидных связей |
|
Д. Ковалентных связей |
|
2. В формировании третичной структуры ДНК принимают участие: |
Б |
А. ТАТА-фактор |
|
Б. Гистоны |
|
В. SSB-белки |
|
Г. РНК |
|
Д. Альбумины |
|
3.Гистоны – белки с высоким содержанием: |
Б |
А. Глу, Асп |
|
Б. Лиз, Apг |
|
В. Лей, Фен |
|
Г. Сер, Тре |
|
Д. Мет, Гли |
|
4. Гистоны входят в состав: |
Б |
А. Рибосом |
|
Б. Нуклеосом |
|
В. Репликативного комплекса |
|
Г. Сплайсосом |
|
Д. Репаративного комплекса |
|
5. Нуклеосомы участвуют в: |
Б |
А. Репликации |
|
Б. Компактизации ДНК |
|
В. Повышении отрицательного заряда ДНК |
|
Г. Транскрипции |
|
Д. Сплайсинге |
|
6. Минорные основания: |
Г |
А. Образуются в результате дезаминирования урацила |
|
Б. Образуют ковалентные связи, стабилизирующие 3-ю структуру РНК |
|
В. Снижают устойчивость РНК к действию нуклеаз |
|
Г. Препятствуют спирализации определенных участков РНК |
|
Д. Участвуют в образовании комплементарных пар |
|
7. Денатурация ДНК сопровождается: |
Г |
А. Образованием ковалентных «сшивок» между цепями |
|
|
|
|
|
Б. Гидролизом 3',5'-сложноэфирной связи между мономерами |
|
В. Нарушением первичной структуры цепей ДНК |
|
Г. Разрывом водородных связей между цепями ДНК |
|
Д. Гидролизом N-гликозидной связи в мономерах |
|
8. ДНК-лигаза: |
В |
А. Не входит в состав репликативного комплекса |
|
Б. Синтезирует фрагменты цепей ДНК |
|
В. «Сшивает» фрагменты Оказаки |
|
Г. Катализирует гидролиз 3',5'-фосфодиэфирной связи |
|
Д. Активируется ТАТА-фактором |
|
9. К накоплению повреждений в ДНК приводит снижение скорости: |
Б |
А. Репликации |
|
Б. Репарации |
|
В. Транскрипции |
|
Г. Сплайсинга |
|
Д. Образования минорных нуклеотидов |
|
10. В процессе репарации: |
В |
А. Устраняются повреждения в комплементарных парах |
|
Б. Вырезаются дезаминированные нуклеотиды из цепей РНК |
|
В. Синтезируются новые цепи ДНК, идентичные матрице |
|
Г. Устраняются повреждения в ДНК |
|
Д. Метилируются остатки аденина в последовательности -GATC- |
|
11.Транскрипция: |
Д |
А. Происходит в S-фазу клеточного цикла |
|
Б. Начинается с кодона AUG |
|
В. Инициируется образованием праймера |
|
Г. Не требует локального расплетения двойной спирали ДНК |
|
Д. Протекает при участии ТАТА-фактора |
|
