
Тесты из задачника 989898FF
.pdf57. |
1-В, 2-Б |
|
1. |
Арг гуанидиновую группу |
|
2. |
Гис имидозольное кольцо |
|
3. |
Сер Гидроксильную группу |
|
А. карбоксильную группу |
|
|
Б. имидозольное кольцо |
|
|
В. гуанидиновую группу |
|
|
Г. Гидроксильную группу |
|
|
Д. Амидную группу |
|
|
58. |
1-В, 2-Д |
|
1. |
Глу карбоксильную |
|
2. |
Лиз Амино |
|
3. |
Асн амидную |
|
А. амидную |
|
|
Б. гуанидиновую |
|
|
В. карбоксильную |
|
|
Г. тиольную |
|
|
Д. амино |
|
|
|
|
|
59. |
59. 1-Б, |
|
1. |
Про – Лей – Тре Пептид, с N концевой иминокислотой |
А |
2. |
Мет – Ала - Про Пептид, плохо растворимый в воде |
|
3. |
Асн – Глу – Гис Пептид, хорошо растворимый в воде |
|
А. Пептид, хорошо растворимый в воде |
|
|
Б. Пептид, с N концевой иминокислотой |
|
|
В. Пептид с суммарным отрицательным зарядом |
|
|
Г. |
Пептид, плохо растворимый в воде |
|
Д. Пептид с С- концевой ароматической аминокислотой |
|
|
60. |
1-Д, 2-Г |
|
1. |
Мет- Сер-Глн Пептид с N-коневой серусодержащей |
|
|
аминокислотой |
|
2. |
Тре – Арг –Гис Пептид с суммарным положительным зарядом |
|
3.Три – Иле – Про Пептид, плохо растворимый в воде |
|
|
А. Пептид с суммарным отрицательными зарядом |
|
|
Б. Пептид, плохо растворимый в воде |
|
|
В. Пептид с ароматической аминокислотой |
|
|

Г. Пептид с суммарным положительным зарядом
Д. Пептид с N-коневой серусодержащей аминокислотой |
|
|
|
|
|
61. |
1-Б, 2-В |
|
1. |
Лей, Три гидрофобную |
|
2. |
Глн, Сер водородную |
|
3. |
Гис, Асп ионную |
|
А. ионную |
|
|
Б. гидрофобную |
|
|
В. водородную |
|
|
Г. дисульфидную |
|
|
Д. пептидную |
|
|
62. |
1-В, 2-Б |
|
1. |
Асн, Глн водородную |
|
2. |
Мет, Про гидрофобную |
|
3. |
Лиз, Асп ионную |
|
А. ионную |
|
|
Б. гидрофобную |
|
|
В. водородную |
|
|
Г. дисульфидную |
|
|
Д. пептидную |
|
|
63. |
1-Б, 2-В |
|
1. |
первичная структура определяет конформацию белка |
|
2. |
вторичная структура пространственная укладка пептидного |
|
|
остова |
|
3. |
третичная структура образована межрадикальными |
|
|
взаимодействиями |
|
А. специфический порядок чередования вторичных структур |
|
|
Б. определяет конформацию белка |
|
|
В. пространственная укладка пептидного остова |
|
|
Г. состоит из нескольких полипептидных цепей |
|
|
Д. образована межрадикальными взаимодействиями |
|
|

64.Связи образуются между: |
1-В, 2-Д |
|
1. |
Водородные |
|
2. |
Гидрофобные |
|
3. |
Дисульфидные |
|
А. α амино и α карбоксильными группами соседних а.к |
|
|
Б. остатками цистеина |
|
|
В. атомами пептидного остова |
|
|
Г. радикалами Асп и Гис |
|
|
Д. Радикалами Мет и Три |
|
|
65. |
1-Б, 2-В |
|
1.Стабилизирована водородными связями между атомами пептидного остова
2.Формируется за счет взаимодействия радикалов аминокислот
3.Образуется при синтезе белка на рибосоме
Структуры белка: А. Первичная Б.Вторичная В. Третичная
Г. Супервторичная
Д.Конформация
66. |
1-В, 2-Д |
1.Третичная структура
2.Конформация
3.Активный центр
А. Пространственная структура, |
образованная укладкой пептидного |
остова |
|
Б. Специфический порядок чередования вторичных структур |
|
В. Структура, образованная межрадикальными взаимодействиями |
|
Г. Участок белка, комплементарный лиганду |
|
Д. Пространственная структура белка. |
|
67. 1. Ацетилхолин |
1-В, 2-А |
2. Атропин |
|
3. Дитидин |
|
А. Конкурентный ингибитор функций М-холинорецепторов |
|
Б. Агонист М-холинорецепторов |
|
В. Лиганд М и Н-холинорецепторов |
|
Г. Агонист Н-холинорецепторов |
|
Д. Конкурентный ингибитор Н-холинорецепторов |
|

68.Содержит: |
1-В, 2-Б |
1.Простой белок
2.Сложный белок
3.Доменный белок
А. несколько полипептидных цепей |
|
|
Б. |
небелковую часть |
|
В. |
только белковую часть |
|
Г. несколько участков цепи, свернутых как отдельные белки |
|
|
Д. сложное чередование вторичных структур |
|
|
69.Миоглобин |
1-Г, 2-Б |
|
1.Вторичная структура
2.Третичная структура
3.Активный центр
А.Расположен между α спиралями С и Д |
|
|
Б. Глобула с гидрофобным ядром |
|
|
В. Присоединяет гем |
|
|
Г. Имеет 8 α спиралей |
|
|
Д. Содержит Fe 3+ |
|
|
70. Лиганды гемоглобина |
1-Д, 2-В |
|
1. |
О2 |
|
2. |
Н+ |
|
3. |
2,3, БФГ |
|
А. Присоединяется в центральной полости окси Нb |
|
|
Б. Повышает сродство Нb к О2 |
|
|
В. Образуется при диссоциации угольной кислоты |
|
|
Г. Аллостерический лиганд |
|
|
Д. Присоединяется в активном центре Нb |
|
|
|
|
|
71.Лиганды гемоглобина |
1-Г, 2-В |
|
1.СО
2.О2
3.2,3 БФГ
А. синтезируется в эритроцитах Б. повышает сродство Нb к О2
В. лиганд, определяющий функцию Нb Г. конкурентный ингибитор Нb
Д. взаимодействует с Fe 3+ в составе гема
72. Гемопротеины |
1-А, 2- |
|
1. |
Миоглобин |
|
2. |
Гемоглобин А |
|
3. |
Гемоглобин S |
|
А. мономер |
|
|
Б. фосфопротеин |
|
|
В. мутантная форма гемоглобина |
|
|
Г. содержит Fe 3+ |
|
|
Д. основной белок эритроцитов |
|
|
Раздел дисциплины (тема): Строение и свойства ферментов. Классификация ферментов. Кинетика ферментативного катализа.
Вопрос |
|
Ответ |
|
|
|
1. Ферментами называют: |
|
Г |
А. Вещества, катализирующие как прямую, так и обратную реакции. |
|
|
Б. Вещества - участники химических реакций. |
|
|
В. Белки, комплементарно связывающие лиганды. |
|
|
Г. Биологические катализаторы белковой природы. |
|
|
Д. Белки, способные соединяться только с одним субстратом. |
|
|
2. Ферменты в отличие от небелковых катализаторов: А. |
|
Д |
Соединяются с субстратом обратимо. |
|
|
Б. Не изменяют состояние равновесия реакции. |
|
|
В. После реакции обнаруживаются в неизменном виде и количестве. |
|
|
Г. Уменьшают энергию активации. |
|
|
Д. Узнают свой субстрат при наличии множества других соединений. |
|
|
3.Субстратная специфичность ферментов обусловлена: |
|
А |
А. Комплементарностью активного центра фермента и субстрата. |
|
|
Б. Химическим соответствием активного центра фермента субстрату. |
|
|
В. Наличием кофермента. |
|
|
Г. Набором определенных функциональных групп в активном центре |
|
|
фермента. |
|
|
Д. Пространственным соответствием активного центра фермента субстрату. |
|
|
4. Ферменты, обладающие каталитической специфичностью: |
|
Б |
А. Способны взаимодействовать только с одним субстратом. |
Б. |
|
Катализируют различные превращения одного и того же субстрата. |
|
|
В. Катализируют только одно превращение субстрата из всех возможных. Г. |
|
|
Способны к соединению субстрата с активным центром по принципу |
|
|
комплементарности. |
|
|
Д. Катализируют один тип реакции с более чем одним структурноподобным |
|
|
субстратом. |
|
|

5. Ферменты, обладающие относительной субстратной специфичностью: А. |
В |
|||||||
Присоединяют субстрат к активному центру по принципу |
|
|||||||
комплементарности. |
|
|
|
|||||
Б. Катализируют только одно превращение субстрата из всех возможных. |
|
|||||||
|
|
|
|
|
|
|
||
В. Катализируют один тип реакции с более чем одним |
|
|||||||
структурноподобным субстратом. |
|
|||||||
Г.Способны взаимодействовать только с одним субстратом. |
|
|||||||
Д.Изменяют конформацию фермента в процессе химической реакции |
|
|||||||
6. Глюкокиназа в отличие от гексокиназы: |
Г |
|||||||
А. Имеет более высокое сродство к глюкозе. |
|
|||||||
Б. Катализирует реакцию: |
|
|
|
|||||
Глюкоза + АТФ |
Глюкозо-6-фосфат + АДФ. В. |
|
||||||
Содержится в клетках многих органов. |
|
|||||||
Г. Имеет более высокое значение KM. |
|
|||||||
Д. Катализирует обратимую реакцию. |
|
|||||||
|
|
|
|
|
|
|
|
|
H3C |
|
O |
|
|
Б |
|||
N |
|
|
|
|||||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
NH |
|
|
|
|
|
|
|
|
||
7 |
|
|
|
|
N |
|
OH3C . Эта структура является компонентом |
|
|
|
|
|
|
|
|||
кофермента: |
|
|
|
|
|
|||
А. Биотина. |
|
|
|
|
|
|||
Б. ФАД. |
|
|
|
|
|
|||
В. НАД+. |
|
|
|
|
|
|||
Г. Пиридоксальфосфата. Д. |
|
|
|
|||||
KoA. |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
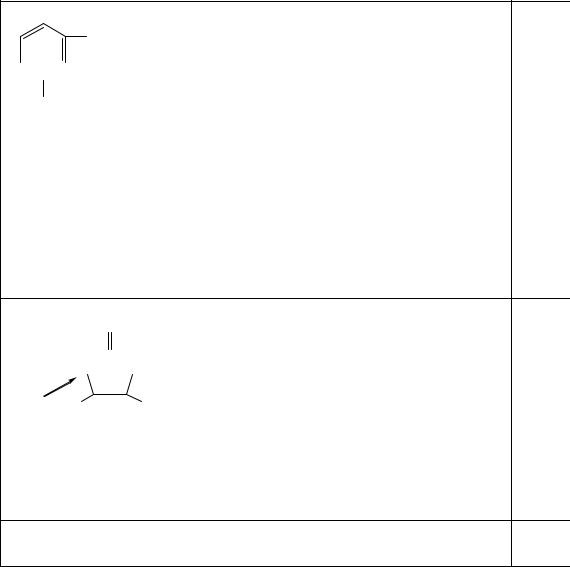
8. Эта структура является компонентом кофермента: |
В |
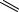 +
+ 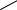
N
CONH2
R
А. Биотина. Б. ФАД.
В.НАД+.
Г.Пиридоксальфосфата.
Д.KoA.
9. Эта структура является компонентом кофермента: |
А |
O
 C
C 
HN NH
CO2
А. Биотина.
Б. ФАД. В. НАД+.
Г. Пиридоксальфосфата.
Д. KoA.
10. Эта структура является компонентом кофермента: |
Г |


20. Аспирин по механизму действия является: |
Б |
А. Является обратимым ингибитором; |
|
Б. Является необратимым ингибитором; |
|
В. Структурно похож на субстрат; |
|
Г. Вызывает конкурентное ингибирование активности фермента; |
|
Д. Является антиметаболитом. |
|
21. Конкурентные ингибиторы ферментов изменяют: |
Б |
А. Vmax катализируемой реакции; |
|
Б. Км реакции; |
|
В. Vmax и Км реакции; |
|
Г. Специфичность к субстрату; |
|
Д. Первичную структуру фермента. |
|
22. Лекарственный препарат прозерин в отличие от отравляющего вещества |
Д |
зарина: |
|
А. Уменьшает активность ацетилхолинэстеразы; |
|
Б. Связывается в активном центре фермента; |
|
В. Образует с ферментом ковалентную связь; |
|
Г. Ингибирует ферменты с остатком серина в активном центре; |
|
Д. Является обратимым ингибитором. |
|
23. Для увеличения концентрации цАМФ можно использовать: |
А |
А. Ингибиторы фосфодиэстеразы; |
|
Б. Ингибиторы аденилатциклазы; |
|
В. Ингибиторы протеинкиназы А; |
|
|
|
|
|
Г. Активаторы фосфодиэстеразы; Д. |
|
Активаторы протеинфосфатазы. |
|
|
|
24. Примером необратимой регуляции активности ферментов является: |
Д |
А. Фосфорилирование под действием протеинкиназ; |
|
Б. Аллостерическая регуляция; |
|
В. Дефосфорилирование под действием фосфопротеинфосфатаз; Г. |
|
Ингибирование конкурентными ингибиторами; |
|
Д. Частичный протеолиз ферментов. |
|
25. К активации аллостерических ферментов приводит: |
В |
А. Химическая модификация фермента; |
|
Б. Гидролиз пептидных связей, |
|
В. Кооперативное взаимодействие субъединиц; |
|
Г. Разрыв связей между субъединицами; |
|
Д. Фосфорилирование молекулы фермента. |
|
26. По механизму частичного протеолиза активируется фермент: |
Б |
А. Лактатдегидрогеназа; |
|
Б. Пепсин; |
|
В. Креатинкиназа; |
|
Г. Аспарагиназа; |
|
Д. Щелочная фосфатаза. |
|
