
Физика кр3,4
.pdf
х1 / 2 = ln 2 - слой половинного поглощения. После прохождения этого
µ
слоя интенсивность излучения становится равной I = I 0 .
2
10. Дефект массы ядра
M = ZMp + (A − Z )Mn − Mÿ , где Z–зарядовое число (число протонов в ядре);
А - массовое число (число нуклонов в ядре); (A − Z ) - число нейтронов в ядре;
M - масса протона; M - масса нейтрона; M - масса ядра.
P N Z
11. Энергия связи ядра
Eсв = MC2 ,
где M- дефект массы ядра; с - скорость света в вакууме.
Обычно для расчетов пользуются внесистемными единицами энергии – МэВ и массы – а.е.м. Тогда численное значение коэффициента пропорциональности c2 = 931МэВ .
Примеры решения задач на тему «Атомное ядро. Радиоактивность»
Задача 1. Вычислить дефект массы и энергию связи ядра 37 LI .
Решение.
Масса ядра всегда меньше суммы масс свободных (находящихся вне ядра) протонов и нейтронов, из которых ядро образовалось. Дефект массы ядра
M и есть разность между суммой масс свободных нуклонов (протонов и нейтронов) и массой ядра, т.е.
|
M = ZMp + (A − Z )Mn − Mÿ |
(1) |
|
где Z–зарядовое число (число протонов в ядре); |
|
||
А - массовое число (число нуклонов в ядре); |
|
||
(A − Z ) - число нейтронов в ядре; |
|
|
|
M - масса протона; |
M - масса нейтрона; |
M - масса ядра. |
|
P |
N |
Z |
|
В справочных таблицах всегда даются массы нейтральных атомов, но не ядер, поэтому формулу (1) целесообразно преобразовать так, чтобы в нее входила масса нейтрального атома. Можно считать, что масса нейтрального атома равна сумме масс ядра и электронов, составляющих электронную
оболочку атома: |
|
|
. |
(2) |
A |
Z |
E |
||
M = M |
+ |
Z M |
|
|
Из (2) выразим массу ядра: |
|
|
|
|
|
M = M − ZM . |
|
||
|
Z |
A |
E |
|
61

Выразив в равенстве (1) массу ядра по формуле (2), получаем
M = ZM P + (A − Z )MN − MA + ZME , или
M = Z(M + M )+ (A − Z )M − M .
P E N A
Замечая, что
MP + ME = MH ,
где MH - масса атома водорода, окончательно находим
M = ZMH + (A − Z )MN − MA . |
(3) |
выражение (3) числовые значения масс, получим
m= 3 1,00783 + (7 − 3) 1,00867 − 7,01601 = 0,04216(а.е.м.) .
Всоответствии с законом пропорциональности массы и энергии
E = C2 M ,
где с– скорость света в вакууме. |
|
|
|
Коэффициент |
пропорциональности |
c 2 = 9 1016 ì 2 /ñ2 , |
или |
с2 = Е = 9 1016 Дж / кг .
M
Если вычислить энергию связи, пользуясь внесистемными единицами, то ñ2 = 931ÌýÂ / à.å.ì .
Если вычислить энергию связи, пользуясь внесистемными единицами, то c2 = 931МэВ / а.е.м. С учетом этого формула (4) примет вид
E = 931 M (МэВ).
Подставив найденное значение дефекта массы ядра в формулу (5), получим
E = 931 0,04216 = 39,2(МэВ) .
Ответ: дефект массы ядра 37 LI составляет 0,04216 а.е.м. энергия связи атомного ядра 37 LI равна 39,2МэВ.
Задача № 2. Вычислить энергию ядерной реакции 11P+115 B →324 HE .
Дано:
11P+115 B →324 HE ;
mP = 1,00783а.е.м.;
mB = 10,01294а.е.м.;
mHE = 4,00260а.е.м.
m = 0,00055а..е.м.
E
______________
Q − ?
62
Решение.
Q = (MP + MBЯ − 3MHeЯ ) C2 , (1)
где MP - масса протона;
MBЯ - масса ядра бора;
MHeЯ - масса ядра гелия;
с- скорость света в вакууме.
Пользуясь внесистемными единицами полагают c2 = 931 МэВ .
а.е.м.
При числовых подсчетах по формуле (1) массы ядер бора и гелия находим как разность масс нейтральных атомов и масс электронов, содержащихся в электронных оболочках данных атомов:
Я
MB = MB − 5Me ;
Я
MHe = MHe − 2Me .
Q= (MP + MB − 5ME − 3 MHE + 6 ME ) C2 ;
Q= (MP + MB − 3MHE + ME ) C2
Q= (1,00783а.е.м. +10,01294а.е.м. − 3 4,00260а.е.м. + 0,00055а.е.м.) 931 МэВ = −918,413МэВ;
а.е.м.
Так как Q < 0 , энергия поглощается, реакция является эндотермической.
Ответ: энергия ядерной реакции равна -918,413 МэВ, реакция является эндотермической.
Молекулярно-кинетическая теория идеального газа Основные законы и формулы
1.Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
PV = M RT,
µ
где P- давление газа, V- его объем, T-термодинамическая температура, m- масса газа, µ - масса одного моля газа,
R= 8,31Дж /(моль К ) -универсальная газовая постоянная,
ν= M - число молей.
µ
2. Количество вещества (в молях) |
|
|
|
|
|
N |
или ν = |
M |
, |
ν = |
|
|
||
|
||||
|
NA |
µ |
|
|
где N- число молекул газа, NA = 6,02.1023 моль-1 - постоянная Авогадро.
63

3.Количество вещества в смеси газов определяется по формуле:
ν=ν1+ν2+...+νn =N1/NA +N2/NA +...+Nn/NA
или
ν =m1/µ1 +m2/µ2 +...+mn/µn ,
где νI, Ni, mi, µI - соответственно количество вещества, число молекул, масса, молярная масса i-й компоненты смеси.
Молярная масса смеси газов:
M + M + ... + M |
|
µ = 1 2 |
N , |
ν1 +ν2 + ...νN
где mi - масса i-го компонента смеси, νi - количество вещества i-го компонента смеси, n- число компонентов смеси.
Массовая доля wi i-го компонента смеси газов (в долях единицы)
M
ωI = I ,
M
где m-масса смеси. Концентрация молекул
N = N / V = N A ρ / µ ,
где N- число молекул, содержащихся в данной системе; ρ -плотность веществ; V- объем системы.
Формула справедлива не только для газов, но и для любого агрегатного состояния вещества.
4. По закону Дальтона давление смеси газов равно сумме их парциальных давлений
P = P + P + ... +P , |
|
1 2 |
N |
где n- число компонентов смеси.
Парциальнымдавлением называется давление газа, которое имел бы каждый газ, входящий в состав смеси, при условии, что при данной температуре он один заполнял бы весь объем.
5.Основное уравнение молекулярно-кинетической теории:
P = N0 KT
или
2
P = 3 N0 < εN > ,
где P - давление газа;
N0 - число молекул в единице объема;
R
K = = 1,38 10−23 Äæ/Ê - постоянная Больцмана;
NA
<εN > - средняя кинетическая энергия поступательного движения одной
молекулы;
64
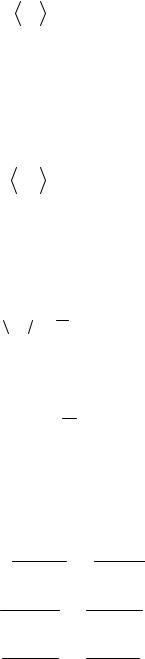
Ò - абсолютная температура.
6.Средняя кинетическая энергия поступательного движения молекулы:
εï |
= |
3 |
KT , |
|
2 |
||||
|
|
|
где k = 1,38 10−23 Äæ / Ê - постоянная Больцмана.
Средняя полная кинетическая энергия молекулы:
|
i |
|
ε ï = |
|
kT , |
2 |
||
где i–число степеней свободы молекулы (для одноатомного газа i= 3; для двухатомного газа i= 5; для многоатомного газа i= 6).
Средняя кинетическая энергия, приходящаяся на одну степень свободы:
 ε1
ε1  = 1 KT 2
= 1 KT 2
Средняя кинетическая энергия поступательного движения молекул
3
< εN >= 2 KT ,
где k = 1,38 10−23 Äæ / Ê -постоянная Больцмана;
7. Скорости молекул:
средняя квадратичная скорость
< Vкв >= 
 3KT / Mi =
3KT / Mi = 
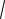 3RT / µ ,
3RT / µ ,
средняя арифметическая скорость
< V >= 
 8KT / πMi =
8KT / πMi = 
 8RT / πµ ,
8RT / πµ ,
наиболее вероятная скорость
VHВ = 
 2KT / Mi =
2KT / Mi = 
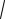 2RT / µ ,
2RT / µ ,
где mi - масса одной молекулы.
8. Закон для распределения молекул идеального газа по скоростям (закон Максвелла):
|
|
3 |
|
|
M υ 2 |
||
|
M 2 |
2 |
|
0 |
|
||
F (υ) = 4π |
0 |
|
υ E |
− |
(2KT ) |
||
|
|||||||
|
|
, |
|||||
2πKT |
|
|
|||||
|
|
|
|
||||
где F (υ) - функция распределения молекул по скоростям.
9. Распределение Больцмана (распределение частиц в силовом поле)
65
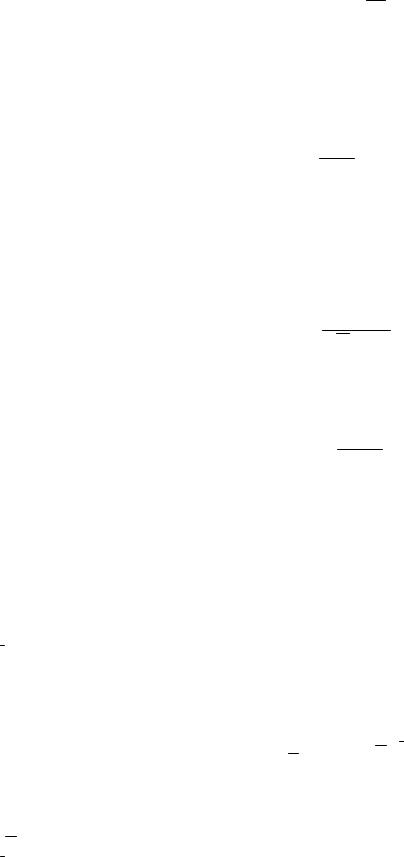
E N
−
KT
N = N 0 E ,
где n- концентрация частиц, En - потенциальная энергия молекулы в поле тяготения, n0 - концентрация частиц в тех точках поля, где En= 0.
10. Барометрическая формула, выражающая зависимость давления идеального газа от высоты hнад поверхностью Земли
−µgh
P = P0E RT
где P - давление газа на высоте HI ;
P0 - давление газа на высоте H = 0 ;
Т- термодинамическая температура воздуха на высоте H = 0 . 11.Средняя длина <l> свободного пробега молекул газа
1
< L >= 
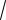 2πD 2 N ,
2πD 2 N ,
где d- эффективный диаметр молекул; n– концентрация молекул газа.
12.Среднее число соударений молекул в единицу времени
<Z >= < V > .
<L >
13.Динамическая вязкость (коэффициент внутреннего трения):
1 |
|
|
|
|
1 |
|
|
|
|
|
||
|
|
|
|
|||||||||
ρ V |
|
N0 MIV L , |
||||||||||
η = |
|
L = |
|
|||||||||
|
|
|||||||||||
3 |
|
|
3 |
|
|
|
|
|
||||
где ρ - плотность газа (жидкости); N0 - концентрация молекул газа; Mi - масса одной молекулы;
L- средняя длина свободного пробега молекул.
14.Теплопроводность (коэффициент теплопроводности) газа:
1
λ = 3 Cуд.V ρ υ L ,
где Cóä.V - удельная теплоемкость газа при постоянном объеме;
ρ- плотность газа;
υ - средняя арифметическая скорость молекул;
Lсредняя длина свободного пробега молекул
15.Диффузия (коэффициент диффузии):
66
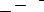
1
Д = υ l .
3
Примеры решения задач на тему «Молекулярно-кинетическая теория идеального газа»
Задача 1. Баллон содержит 80 г кислорода и 300 г аргона. Давление смеси 10 атм, температура 150С. Принимая данные газы за идеальные, определить емкость баллона.
Дано: m1 = 80 г = 8.10-2кг; Аr m2 =300 г = 3.10-1кг;
t= 150C; Т= 288К.
P= 10 атм = 1,01.106 Па.
_____________________
V- ? Решение.
По закону Дальтона давление смеси равно сумме парциальных давлений газов, входящих в состав смеси. Парциальным давлением газа называется давление, которое производил бы газ, если бы только он один находился в сосуде, занятом смесью.
По уравнению Менделеева-Клапейрона парциальные давления кислорода P1 и аргона P2 выражаются формулами
P1 = |
M1 |
|
RT |
|
и |
|
|
|
|
M2 |
|
RT |
(1) |
||||
|
|
|
|
|
|
|
|
|
P2 = |
|
|
|
. |
||||
|
|
V |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|||||||||||
µ1 |
|
|
|
|
|
|
µ2 |
|
V |
|
|||||||
По закону Дальтона для смеси газов |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
P=P1 +P2, |
|
|
|
(2) |
||||||||
или |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
M2 |
|
|
RT |
|
|
|
|
|||||
|
P = |
M1 |
+ |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
, |
|
|
|
(3) |
|||||||
|
|
|
µ1 |
|
µ2 |
|
|
V |
|
|
|
||||||
где R = 8,31Äæ /(ìîëü Ê) - молярная газовая постоянная Из (3) выражаем объем баллона:
M |
|
M |
|
|
|
RT |
|
||
V = |
1 |
+ |
|
2 |
|
|
|
. |
(4) |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
µ1 |
|
µ2 |
|
|
P |
|
|||
Проверим размерность расчетной формулы:
67
[V ] = 1моль |
1Дж 1К 1м2 |
= |
1Н 1м 1м3 |
= м3 . |
|
1моль 1К 1Н |
|
1Н |
|||
|
|
|
|
||
Подставим числовые значения в формулу (4) и произведем вычисления:
V = ( |
0,08 |
+ |
0,3 |
) ( |
8,31 288 |
) ≈ 0,024(м3 ) ≈ 24л. |
32 10−3 |
40 10−3 |
|
||||
|
|
10 1,01 105 |
|
|||
Ответ: объем баллона равен 24 л.
Задача 2. Найти кинетическую энергию вращательного движения одной молекулы кислорода при температуре 130С, а также кинетическую энергию вращательного движения всех молекул, содержащихся в 4 г кислорода.
Дано:
m = 4ã = 4 10−3 êã ;
T = 13O C; T = 286Ê ;
µ = 32 10−3 êã / ìîëü .
_____________
εвр -? Wвр -?
Решение.
Известно, что на каждую степень свободы молекулы газа приходится одинаковая энергия, выражаемая формулой
ε 0 |
= |
1 |
KT , |
(1) |
|
2 |
|||||
|
|
|
|
где k- постоянная Больцмана, T- абсолютная температура газа.
Так как вращательному движению двухатомной молекулы (молекула кислорода - двухатомная) приписываются две степени свободы, то энергия вращательного движения молекулы кислорода выразится формулой
|
|
ε = 2 |
1 |
KT . |
(2) |
|
|
|
|
||||
|
|
|
вр |
2 |
|
|
|
|
|
|
|
|
|
ε |
0 |
= 1,38 1023 |
286 = 3,94 10−21 |
(Дж). |
||
|
|
|
|
|
|
|
Кинетическая энергия вращательного движения всех молекул газа:
W = Nε |
вр , |
(3) |
вр |
где N- число всех молекул газа.
Число молекул N можно получить по формуле
68
N = N Aν , |
(4) |
||||||||
где NA - число Авогадро, ν - количество вещества в молях: |
|
||||||||
|
M |
|
|
|
|
|
|||
ν = |
|
|
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
µ |
|
|
|
|
|
|
|||
где m-масса газа, µ - масса одного моля газа, следовательно, |
|
||||||||
|
N = N A |
M |
. |
(5) |
|||||
|
µ |
||||||||
|
|
|
|
|
|
|
|||
Подставив это выражение N в формулу (3), получим |
|
||||||||
Wв р |
= NA |
M |
εв р . |
(6) |
|||||
µ |
|||||||||
|
|
|
|
|
|
|
|||
Подставим численные значения физических величин в формулу (6) и произведем вычисления, получим:
W |
= 6,02 1023 |
4 10−3 |
3,94 10−21 = 296( Дж). |
|
32 10=3 |
||||
в р |
|
|
Ответ: кинетическая энергия вращательного движения одной молекулы кислорода при температуре 130С равна 3,94 10−21 Дж, кинетическая энергия вращательного движения всех молекул равна 296 Дж.
Задача 3. В современной вакуумной камере достигается вакуум порядка 0,1 нПа. Какова средняя длина свободного пробега молекул азота в камере при температуре 27O C . Чему равно среднее число столкновений каждой молекулы с остальными в единицу времени?
(Массу молекулы азота считать равной 5.10-20 кг).
Дано:
N2
P=0,1 нПа=10-10Па;
T = 27O C ; Т=300К; m1 = 5.10-20 кг.
_________________
L -? <z>-?
Решение.
Средняя длина свободного пробега молекул определяется из соотношения:
69
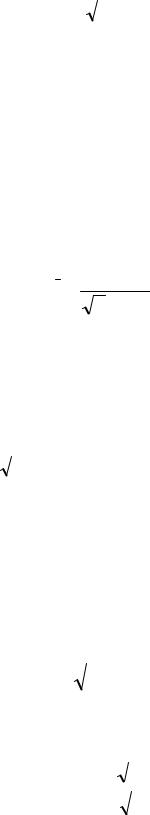
|
< V > |
1 |
|
|
|
||||
<L >= |
|
|
= |
|
|
|
|
, |
(1) |
|
|
|
|
||||||
|
< Z > |
|
|
2πσ2N |
|||||
где <v> - средняя арифметическая скорость молекул,
<z> - среднее число столкновений каждой молекулы с остальными в единицу времени,
n- концентрация молекул газа, σ - эффективный диаметр молекулы. Концентрация молекул газа связана с его давлением соотношением:
P = NKT , |
(2) |
где к– постоянная Больцмана, Т– термодинамическая температура. Таким образом,
êÒ |
|
l = |
|
2πσ 2 P . |
(3) |
Эффективный диаметр молекулы σ =3 10-10м, Постоянная Больцмана к=1,38 10-23 Дж/К, Произведем вычисления по формуле (3):
|
|
|
|
|
1,38 10−23 |
300 |
|
|
8 |
|
l = |
|
≈ 1 10 |
(ì ). . |
|||||||
|
|
|
|
|
|
|||||
|
|
|
−20 |
−10 |
|
|||||
2 3,14 9 10 |
|
|||||||||
|
|
|
|
10 |
|
|
|
|
||
Из формулы (1) выразим среднее число столкновений <z> молекул в единицу времени:
|
|
|
< Z |
|
< V > |
|
|
|
||||||||||
|
|
|
>= |
|
|
|
|
|
|
, |
|
|
|
|
|
|
(4) |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
< L > |
|
|
|
||||||||||
где средняя арифметическая скорость молекул |
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
< V >= |
|
|
8KT / πM1 . |
|
|
(5) |
|||||||||
|
|
Подставим выражение (5) в формулу (4), получим:: |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8KT |
|
|
|
|||
|
|
|
|
Z = |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
, |
|
|||||
|
|
|
|
|
|
|
|
L π M1 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
где k = 1,38 10−23 Äæ \ Ê |
- |
постоянная Больцмана; Т- термодинамическая |
||||||||||||||||
температура; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|||||||||||||||
L - средняя длина свободного пробега молекул; |
M1 - масса одной молекулы. |
|||||||||||||||||
70
