
Физика кр3,4
.pdf
P = M0ϑ = 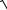
 2MO EK ,
2MO EK ,
где Ек - кинетическая энергия частицы
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
EK |
= |
MOV |
. |
|
|
|
|
|
|
|||
|
|
|
|
|
|
2 |
|
|
2. Соотношения неопределенностей: |
||||||||
|
A |
) |
X |
P ≥ |
ћ |
|
|
(для координаты и импульса), |
|
|
|
X |
|
|
|||
где |
рX - неопределенность проекции импульса на ось x, ›X - |
|||||||
неопределенность координаты x; |
|
|
|
|
||||
|
|
|
б) |
E T ≥ ћ |
|
|
( для энергии и времени), |
|
где |
E - неопределенность энергии; |
|||||||
t |
- время жизни квантовой системы в данном энергетическом |
|||||||
состоянии. |
|
|
|
|
|
|
|
|
3. Нерелятивистское уравнение Шредингера относительно основной |
|||||||||||||||||||||
характеристики состояния микрообъектов – волновой функции ψ (R , T ) имеет вид: |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
2 |
|
∂ |
2 |
|
∂ |
2 |
|
∂ |
2 |
|
|
∂ |
|
|||
|
|
|
|
h |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
||||||
− |
|
|
|
|
|
|
+ |
|
|
|
+ |
|
|
|
|
|
ψ |
||||
|
|
|
|
∂x |
2 |
∂y |
2 |
∂z |
2 |
ψ + U (r , t) ψ = ih |
|
||||||||||
|
|
|
2m |
|
|
|
|
|
|
|
∂t |
||||||||||
4.СтационарноеуравнениеШредингераобычно записывают в виде:
ψ + 2M (E −U )ψ = 0
H2
Явный вид стационарного уравнения Шредингера определяется
конкретной зависимостью U ( R) .
R
Примеры решения задач по теме «Волновые свойства частиц»
Задача 1. Электрон, начальной скоростью которого можно пренебречь, прошел ускоряющую разность потенциалов U. Найти длину волны де Бройля для двух случаев: 1) U1 = 51 B; 2) U2 = 510 кВ.
Дано:
электрон
U1 = 51 B;
U2 = 510 кВ= 5,1.10 5 В.
_________________
λ - ?
51

Решение
Длина волны де Бройля λ для частицы зависит от ее импульса р и определяется формулой:
λ = |
h |
, |
(1) |
|
|||
|
p |
|
|
где h- постоянная Планка.
Импульс частицы можно определить, если известна ее кинетическая энергия Ек . Связь импульса с кинетической энергией различна для нерелятивистского случая (когда кинетическая энергия частицы много меньше энергии ее покоя) и для релятивистского случая (когда кинетическая энергия сравнима с энергией покоя частицы).
В нерелятивистском случае
|
|
|
|
P = 2MO EK , |
(2) |
||||||||||||
где mo - масса частицы. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
В релятивистском случае |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
P = |
|
|
(2EO + EK )EK |
, |
|
|
|
|
(3) |
||||||||
|
|||||||||||||||||
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Где E0 = M0C2 - энергия покоя частицы. |
|
|
|
|
|
|
|
|
|
||||||||
Запишем Формулу (1) с учетом соотношений (2) и (3) |
|
||||||||||||||||
в нерелятивистском случае: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
λ |
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
= |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
2M |
O |
E |
, |
|
|
(4) |
|||
|
|
|
|
|
|
|
|
|
|
|
K |
|
|||||
в релятивистском случае: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
λ = |
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
. |
(5) |
||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
(2EO + EK )EK |
|
||||||||
|
|
|
|
|
|
C |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Сравним кинетические энергии электрона, прошедшего заданные в условии задачи разности потенциалов U1 = 51В и U2 = 510кВ , с энергией покоя электрона..
Как известно, кинетическая энергия электрона, прошедшего ускоряющую разность потенциалов U, равна
Eê = E U
В первом случае
Eê = e U1 = 51ýÂ = 0,51 10−4 ÌýÂ , что много меньше энергии покоя электрона.
Следовательно, в этом случае можно применить формулу (4). Для упрощения расчетов заметим, что Ек =10−4 т0 с2 .
Подставив это выражение в формулу (4), перепишем ее в виде
52

λ1 = |
|
H |
|
|
102 |
|
|
H |
|||||||
|
|
|
|
|
= . |
|
. |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2M |
. |
10 |
−4. |
M C |
2 |
2 |
|
|
M C |
||||
|
|
|
|
|
|
|
|
|
|
|
O |
||||
|
|
O |
|
|
|
O |
|
|
|
|
|
|
|
|
|
Учитывая, что выражение H есть комптоновская длина волны
M0C
λê = 2,43ïì , получим
λ1 = 102 λê .
 2
2
λ1 = 102 2,43пм = 171пм .  2
2
Во втором случае кинетическая энергия
Eк = e U2 = 510кэВ = 0,51МэВ .
Кинетическая энергия электрона равна его энергии покоя. В этом случае необходимо применить релятивистскую формулу (5).
Учитывая, что Eк = 0,51МэВ = m0c2 ,
по формуле (5) найдем длину волны де Бройля:
λ2 |
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
H |
|
|
|
|||
= |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= |
|
|
|
|
|
||
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
2 |
|||||||
|
|
|
|
2 |
|
|
|
|
2 |
|
|
|
|
2 |
|
|
|
||||||
|
|
|
|
|
(2MO C |
|
+ MO C )MO C |
|
|
|
|
3M0 C |
|
|
|
||||||||
|
|
|
C |
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
или λ2 = |
λ |
ê |
|
. |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
λ2 = |
|
2,43 |
|
ïì |
|
= 1,4ïì . |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Ответ: длинf волны де Бройля в первом случае равна 171 пм, во втором случае длина волны де Бройля равна 1,4 пм.
Задача 2. Кинетическая энергия электрона в атоме водорода составляет величину порядка 10 эВ. Используя соотношение неопределенностей, оценить минимальные размеры атома.
Дано:
Eê = 10ýÂ = 10 1,6 10−19 Äæ = 1,6 10−18 Äæ
53

__________________________________
LMIN − ?
Решение. |
|
|
|
|
|
Соотношение неопределенностей для координаты и импульса |
имеет вид |
||||
P |
X ≥ |
|
|
|
|
H |
, |
(1) |
|||
X |
|
|
|
||
где P - неопределенность импульса частицы (электрона),
X
X- неопределенность координаты частицы (в данном случае электрона),
ħ- приведенная постоянная Планка.
Из соотношения неопределенностей следует, что чем точнее определяется положение частицы в пространстве, тем более неопределенным становится импульс, следовательно, и энергия частицы. Пусть атом имеет линейные
размеры L , тогда электрон атома будет находиться где-то в пределах области с неопределенностью
X = |
L |
. |
(2) |
|
|||
2 |
|
|
|
В этом случае соотношение неопределенностей можно записать в виде
pX |
|
l |
≥ |
|
, |
|
|
h |
(3) |
||||||
|
|||||||
|
2 |
|
|
|
|
||
откуда
l ≥ |
2 H |
. |
|
|
(4) |
||
|
pX |
||
|
|
||
Физически разумная неопределенность импульса не должна превышать значение самого импульса, т. е.
|
|
|
|
|
|
P ≤ P . |
|
|
|
(5) |
||||
Импульс связан с кинетической энергией соотношением: |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P = |
|
2MEK . |
|
|
|
(6) |
|||||
C учетом выражений (5) и (6) перейдем к равенству |
|
|||||||||||||
|
|
|
|
|
|
2H |
|
|
|
|
||||
|
|
|
l = |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
2mEк . |
|
|
|
(7) |
|||||||||
|
|
|
|
|
|
|
|
|||||||
Произведем вычисления, получим: |
|
|
|
|
||||||||||
l |
|
|
2.1,05.10−34 |
|
|
= 1,231 10− 10 |
( м) |
|||||||
= |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
. |
||||||
|
MIN |
|
|
|
|
|
|
|
|
|||||
|
|
|
2.9,1 10−31 |
1,6.10−18 |
|
|
|
|||||||
54

Ответ: минимальные размеры атома составляют 1,231 10− 10 ( м) .
Атом водорода по Бору и его квантово-механическое описание
Основные законы и формулы
1. Обобщенная формула Бальмера, описывающая серии в спектре излучения атома водорода,
|
1 |
|
1 |
|
1 |
1 |
|
1 |
|
||
|
ν = R |
|
− |
|
или |
|
= R′ |
|
− |
|
, |
|
|
|
|
|
|
||||||
|
M2 |
|
N2 |
|
λ |
M2 |
|
N2 |
|
||
где ν - частота спектральных линий в спектре атома водорода; |
|||||||||||
R = 3,29 1015 ñ−1 |
– постоянная Ридберга; |
|
|
|
|
|
|
||||
R′ = 1,10 10 7 ì −1 |
- постоянная Ридберга; |
|
|
|
|
|
|
||||
1 - волновое число;
λ
m определяет серию (M= 1,2,3,...) ;
n определяет отдельные линии соответствующей серии (N = M +1, M + 2,...); M = 1 (серия Лаймена),
M = 2 (серия Бальмера),
M = 3 (серия Пашена),
M = 4 (серия Брэкета),
M = 5 (серия Пфунда),
M = 6 (серия Хэмфри).
2. Закон Мозли (спектральные линии характеристического рентгеновского излучения)
1 |
= |
R′ |
Z |
− |
A |
|
2 |
|
1 |
− |
1 |
|
|
|
) |
|
|
|
|
|
, |
||||||
|
( |
|
|
|
|
|
|
||||||
λ |
|
|
|
|
|
|
|
N2 |
|
K |
2 |
|
|
где Z-порядковый номер элемента, n = 1,2,3,…; k =(n+1), (n+2),… а - постоянная экранирования.
Первый постулат Бора (постулат стационарных состояний)
E |
N |
N |
|
ћ, |
(N = 1,2,3...) |
M υ |
R |
= N |
|
|
|
где ME - масса электрона; υN |
- скорость электрона на n-й орбите радиусом |
||||
R .
N
3. Второй постулат Бора (правило частот)
Hν = E − E ,
N M
55

где E и E - энергии стационарных состояний атома соответственно до и
NM
после излучения (поглощения).
4. Радиус n- й стационарной орбиты в боровской модели атома водорода
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
||
|
|
|
|
|
|
|
|
2 |
|
|
H 4πε |
0 |
|
|
|||
|
|
|
|
|
R = N |
|
|
|
|
|
|
|
(N = 1,2,3...) |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
M E 2 , |
||||||||||
|
|
|
|
|
N |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
E |
|
|
|
|
|
где ħ=h/2π - приведенная постоянная Планка; |
|
||||||||||||||||
ε 0 - электрическая постоянная; M0 |
- масса электрона; |
|
|||||||||||||||
e– элементарный заряд. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5. Первый боровский радиус |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
r1 |
= a0 = |
h2 |
4πε0 |
= 52,8ïì |
|
||||||||||||
|
|
|
|
|
|
|
|
||||||||||
m e2 |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
E |
|
|
|
|
||||
6. Энергия электрона в атоме водорода по Бору |
|
||||||||||||||||
|
1 |
|
|
M E4 |
|
|
|
|
|
|
|
|
|
|
|||
N |
N2 |
|
|
E |
|
|
|
|
(N |
= 1 , 2 , 3 ... ) , |
|||||||
|
8H2ε 2 |
|
|
|
|
||||||||||||
E = − |
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
E = − |
13,6 |
ýÂ |
|
|
|
|
(N |
= 1 , 2 , 3 ... ) |
|||||||||
2 |
|
|
|
||||||||||||||
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где h- постоянная Планка; M0 - масса электрона;
e– элементарный заряд.
7. Потенциальная энергия в водородоподобном атоме
ZE2
U = − 4πε0R , где r– расстояние между электроном и ядром; Z– порядковый номер элемента.
8. Собственное значение энергии электрона в водородоподобном атоме
|
1 |
|
Z 2 M |
E4 |
|
||||
|
|
|
|
|
|
E |
|
(N = 1 , 2 , 3 ... ) |
|
N |
= − |
|
|
|
|
|
|
||
N |
2 |
8H |
2ε |
2 |
|||||
|
|
|
|||||||
|
|
|
|
|
|
|
0 |
|
|
56

9. Энергия электрона в атоме водорода при квантово-механическом описании
E |
1 |
|
M E4 |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
E |
|
|
|
|
|
|
|
|
|
|
|
(N = 1 , 2 , 3 ... ) |
||
= − |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
N2 |
8H2ε |
2 |
|
|
|
|
|
|
|
|
|
|
|||||
N |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
10. Энергия ионизации атома водорода |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
M |
E4 |
|||
|
|
|
I = −E1 |
|
|
|
|
|
E |
|
|
|
|
||||
|
|
|
|
= − |
|
|
|
|
|
||||||||
|
|
|
8H2ε |
2 |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
11. Момент импульса (механический орбитальный момент) электрона |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
LI = |
|
|
|
L(L +1) , |
|
|
|||||||
|
|
|
|
H |
|
|
|
|
|||||||||
где L - орбитальное квантовое число, принимающее при заданном n |
|||||||||||||||||
значения: L = 0,1,2,3..., N -1 (всего n значений). |
|
|
|
|
|||||||||||||
12. Проекция момента импульса на |
|
направление Z внешнего магнитного |
|||||||||||||||
поля |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
LIZ |
= |
|
|
|
|
|
|
||||||
|
|
|
|
HML , |
|
|
|
|
|||||||||
где L iZ = M l |
- магнитное |
квантовое |
число, принимающее при |
||||||||||||||
заданном L значения: ML |
= 0,±1,±2,... ± L (всего 2L + 1 значений). |
||||||||||||||||
13. Правило отбора для орбитального и магнитного чисел
L = ±1,
ML = 0,±1 .
Примеры решения задач на тему «Атом водорода по Бору
и его квантово-механическое описание»
Задача 1. Определить энергию ε фотона, соответствующего второй линии в первой инфракрасной серии (серии Пашена) атома водорода.
57

Рис.
Решение.
Энергия ε фотона, излучаемого атомом водорода при переходе электрона с одной орбиты на другую,
|
|
|
1 |
|
1 |
|
|
|
|
2 − |
|
(1) |
|||
|
|
ε = Ei |
2 , |
||||
|
|
|
N1 |
N2 |
|
||
где Ei |
- энергия ионизации атома водорода; |
|
|||||
N1 |
= 1,2,3,... - номер орбиты, на которую переходит электрон; |
|
|||||
N2 |
= N1 +1; N1 + 2;...; N1 + M - номер орбиты, с которой переходит электрон. |
|
|||||
M- номер спектральной линии в данной серии. |
|
||||||
Для |
серии Пашена N1 = 3; |
для |
|
второй линии этой серии |
M= 2 ; |
||
N2 = N1 + M = 3 + 2 = 5 . |
|
|
|
|
|
||
|
|
Подставив числовые значения в формулу (1), найдем энергию фотона: |
|||||
ε = 0,97ýÂ . |
|
|
|
|
|
||
Ответ: энергия фотона, соответствующего второй линии в первой инфракрасной серии (серии Пашена) атома водорода равна 0,97 эВ.
Задача 2. Вычислить радиус первой орбиты атома водорода (боровский радиус) и скорость электрона на этой орбите.
Решение.
Согласно теории Бора, радиус электронной орбиты и скорость электрона на ней связаны равенством MυR = NH , где M- масса электрона, υ - скорость электрона на орбите; r – радиус орбиты; n – главное квантовое число;
h = |
h |
= 1,05 10−34 Дж с - постоянная Планка. |
|
2π |
|||
|
|
Так как в задаче требуется определить величины, относящиеся к первой орбите, то главное квантовое число n=1 и указанное выше равенство примет
вид: |
MυR = NH |
(1) |
Для определения двух неизвестных величин r и υ необходимо еще одно уравнение. В качестве второго уравнения воспользуемся уравнением движения электрона. Согласно теории Бора, электрон вращается вокруг ядра. При этом сила взаимодействия между электрическими зарядами ядра и электрона сообщает электрону центростремительное ускорение. На основании второго закона Ньютона можем записать
58

|
Mυ 2 |
1 |
|
|
|
E2 |
|
||||||
|
|
= |
|
|
|
|
|
|
|
|
. |
(2) |
|
|
|
|
|
|
|
2 |
|||||||
|
R |
|
4πε 0 |
R |
|
||||||||
(еи m—заряд и масса электрона), или |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
1 |
|
2 |
|
|
|
|
|||
Mυ 2 = |
|
|
|
E |
|
. |
|
(3) |
|||||
4πε 0 |
|
|
|
||||||||||
|
|
|
|
|
R |
|
|
|
|
||||
Совместное решение равенств (1) и (3) относительно r дает
4πε 0 H
R = ( 2 ) . (3)
ME
Подставив сюда значения ħ, е, m и произведя вычисления, найдем боровский радиус:
r = a = 5,29 10−11 ì .
Из равенства (1) получим выражение скорости электрона на первой орбите:
H |
|
υ = (MR ) . |
(4) |
Произведя вычисления по формуле (4), найдем значение скорости электрона на электронной орбите:
υ = 2,18Ìì / ñ .
Ответ: радиус первой орбиты атома водорода равен 5,29 10−11 ì ; скорость электрона на электронной орбите равна 2,18Ìì / ñ .
Атомное ядро. Радиоактивность Основные законы и формулы
1. Массовое число ядра (число нуклонов в ядре)
A = Z + N ,
где Z–зарядовое число (число протонов); N– число нейтронов. 2. Закон радиоактивного распада
DN = −λNDT,
Или
N = N0E−λT ,
59

где DN - число ядер, распадающихся за интервал времени DT ; N– число ядер, не распавшихся к моменту времени t;
N0 - число ядер в начальный момент (T = 0);
λ- постоянная радиоактивного распада.
3. Число ядер, распавшихся за время t,
|
N = N0 − N = N0 (1− E−λT ). |
|
|
4. В случае, |
если интервал времени T , за который определяется число |
||
распавшихся |
ядер, много меньше периода полураспада T1 |
, то число |
|
|
|
|
|
|
2 |
|
|
распавшихся ядер можно определить по формуле
N= λN T .
5.Зависимость периода полураспада от постоянной радиоактивного распада
T1 = (LN 2) / λ = 0,693/ λ .
2
6. Среднее время τ жизни радиоактивного ядра, т.е. интервал времени, за который число нераспавшихся ядер уменьшается в е раз,
τ= 1 .
λ
7.Число N атомов, содержащихся в радиоактивном изотопе,
N = MNA ,
µ
где m–масса изотопа; µ - молярная масса;
NA = 6,02 1023 ìîëü |
-1 - постоянная Авогадро. |
8. Активность радиоактивного изотопа |
|
|
A = −DN / DT = λN , |
Или |
A = λN0E−λT = A0 E−λT , |
где DN - число ядер, распадающихся за интервал времени DT ; A0 - активность изотопа в начальный момент времени.
9. Удельная активность изотопа
A
A = .
M
Закон поглощения излучения
I = I 0 EXP(−µX) , где I 0 - интенсивность поглощения на входе в поглощающий слой вещества; I - интенсивность поглощения после прохождения поглощающего слоя вещества; х – толщина слоя вещества; µ – линейный коэффициент поглощения.
60
