
- •ВВЕДЕНИЕ
- •1.1. Основные понятия и определения
- •1.2. Условия фазового равновесия
- •1.3. Правило фаз Гиббса
- •1.5. Фазовые диаграммы для двухкомпонентных систем с ограниченной взаимной растворимостью жидкостей
- •2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
- •2.1. Порядок выполнения работы
- •2.2. Оформление отчета
- •3. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- •4. КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
- •ЛИТЕРАТУРА
- •ОГЛАВЛЕНИЕ
Таким образом, условием фазового равновесия в гетерогенной системе при постоянных значениях давления и температуры является равенство химических потенциалов каждого компонента системы во всех фазах.
1.3. Правило фаз Гиббса
Условие фазового равновесия (см. (4)) не отражает действия внешних факторов на процесс фазового перехода. Уравнение, связывающее между собой число фаз, число независимых компонентов системы и число внешних факторов, влияющих на равновесие, с вариантностью системы было выведено американским ученым Дж. У. Гиббсом и получило название «правило фаз Гиббса».
Это правило можно получить путем простых логических рассуждений. Рассмотрим равновесную гетерогенную систему, К компонентов которой присутствуют во всех Ф фазах. В качестве независимых переменных выберем температуру Т, давление Р и концентрации компонентов. В пределах одной системы температура и давление будут одинаковы во всех фазах. Учитывая равенство (4), условия равновесия в такой системе можно представить следующими уравнениями:
Т = Т |
= ... = ТФ; |
(5) |
|||||||
Р = Р |
|
= ... = РФ; |
|
(6) |
|||||
|
μ1 |
= μ1 = ... = μ1Ф; |
|
||||||
|
μ |
= μ |
|
|
= ... = μ |
Ф |
; |
|
|
|
2 |
2 |
|
||||||
|
2 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
μ |
= μ |
|
|
= ... = μ |
Ф |
; |
(7) |
|
|
3 |
3 |
|||||||
|
3 |
|
|
|
|
|
|||
. . . . . . . . . . . . . . . . . . . |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
μ |
= μ |
|
|
|
Ф |
|
||
|
К |
= ... = μ |
|
|
|||||
|
К |
|
|
|
К |
|
|||
(здесь нижние индексы относятся к нумерации компонентов, верхние — к нумерации фаз).
Определим число независимых переменных, характеризующих состояние конкретной системы. В каждой фазе независимыми являются (К – 1) концентраций компонентов (поскольку сумма молярных долей компонентов в каждой фазе равна единице). Для
8
получения характеристики состава всех фаз число концентраций должно быть равно Ф(К – 1). Тогда общее число параметров, определяющих состояние системы, составит Ф(К – 1) + 2 (число 2 позволяет учесть давление и температуру).
Определим число уравнений, связывающих независимые переменные. Уравнения (5) и (6) представляют собой ряды тождеств. Так как химические потенциалы компонентов являются функциями их концентраций, число уравнений, связывающих концентрации компонентов в равновесной системе, можно определить из равенства химических потенциалов каждого компонента во всех фазах системы (7). Каждая строка системы (7) состоит из (Ф – 1) независимых уравнений. Число строк в системе (7) равно числу компонентов К. Тогда число уравнений, связывающих независимые переменные, составляет К(Ф – 1).
Число степеней свободы С равно разности числа переменных, описывающих состояние системы, и числа уравнений, связывающих эти переменные:
С = [Ф(К −1)+2]−К(Ф −1)
или
С = К +2−Ф. |
(8) |
Уравнение (8) называется правилом фаз Гиббса: в равновесной гетерогенной системе, на которую из внешних факторов влияют только давление и температура, число степеней свободы равно числу компонентов минус число фаз плюс два.
В некоторых случаях состояние системы определяется такими внешними факторами, как электрическое или магнитное поле, поле тяготения и т. п. В общем случае, когда на систему действует n различных факторов, правило фаз Гиббса имеет вид
С = К +n−Ф. |
(9) |
Из уравнения (8) следует, что равновесная термодинамическая система, содержащая К компонентов, не может состоять из более чем (К + 2) фаз. Например, если К = 1 (чистое вещество), то максимальное число равновесных фаз не превышает трех. Если К = 2, то число равновесных фаз в системе может достигать четырех. Если
9
какой-либо внешний фактор, характеризующий систему, поддерживается постоянным, число переменных становится на единицу меньше. Так, при Р = const или Т = const правило фаз Гиббса (9) записывают в виде
С = К −Ф +1. |
(10) |
При постоянстве двух внешних факторов (Р = const, Т = const) число степеней свободы рассчитывают по уравнению
С = К −Ф. |
(11) |
1.4.Равновесие жидкость — жидкость
вдвухкомпонентных системах
Если из внешних факторов на равновесие двухкомпонентной системы влияют только давление и температура, то правило фаз Гиббса выражается уравнением
С = 2+2−Ф = 4−Ф. |
(12) |
Следовательно, в двухкомпонентной системе число фаз, находящихся в равновесии, не может превышать четырех (С = 0, если Ф = 4). Максимальное число независимых параметров состояния системы, т. е. число степеней свободы, равно трем: давление, температура и концентрация (Х1) одного из компонентов, выраженная в молярных долях, поскольку концентрация второго компонента Х2 = (1 −Х1). При выбранных параметрах (Р, Т, Х1) состояние двухкомпонентной системы и равновесных фаз в ней можно охарактеризовать с помощью трехмерной пространственной фазовой диаграммы. Однако для получения характеристики состояния двухкомпонентных систем чаще пользуются плоскими диаграммами состояния, построенными в координатах Х1 −Т или Х1 −Р, которые представляют собой сечения пространственной диаграммы плоскостями при Р = const или
Т = const.
Таким образом, диаграмма, отображающая зависимость свойств системы и существующих в ней фаз от внешних условий, называется фазовой диаграммой или диаграммой состояния.
Так как взаимную растворимость двух жидкостей изучают экспериментально при P = const, обычно применяют фазовые диа-
10
граммы в координатах T −Х при постоянном давлении. Такие диаграммы, отображающие зависимость состава раствора, выраженного в массовых процентах или в молярных долях, от температуры при P = const, часто называют диаграммами растворимости.
Все жидкости в той или иной степени растворимы друг в друге, oднако эта растворимость настолько различна, что системы можно подразделить на несколько групп:
1)практически нерастворимые друг в друге жидкости: бензин – вода, ртуть – вода и др.;
2)ограниченно взаимно растворимые жидкости. Они растворяются лишь частично, и происходит расслаивание системы на две равновесные фазы: анилин – вода, метиловый спирт – гексан, фенол – вода и др.;
3)жидкости с неограниченной взаимной растворимостью: бензол – хлороформ, метиловый спирт – вода, ацетон – вода и др.
Если две жидкости обладают неограниченной взаимной растворимостью (гомогенная система), то Ф = 1, К = 2 и
C= 3−1 = 2.
Вслучае, когда жидкости практически не смешиваются (масло
вводе), Ф = 2, К = 2 и
С= 3−2 = 1,
т. е. с изменением температуры изменяется состав сосуществующих фаз.
1.5. Фазовые диаграммы для двухкомпонентных систем с ограниченной взаимной растворимостью жидкостей
Пусть два жидких компонента А и В (например, вода и анилин) обладают ограниченной взаимной растворимостью. Тогда при постепенном добавлении одной жидкости к другой при данных значениях температуры и давления сначала происходит их взаимное растворение до известного предела, связанного с образованием насыщенного раствора. Дальнейшее прибавление избытка одной жидкости к другой вызывает расслаивание системы с образованием двух фаз (насыщенного раствора компонента А в компоненте В
11
и насыщенного раствора компонента В в компоненте А), находящихся в равновесии. Влияние давления на состав равновесных фаз невелико, так как объемный эффект перехода одной жидкой фазы в другую очень мал вследствие соизмеримости значений молярных объемов жидких фаз. Для заметного изменения взаимной растворимости двух жидкостей при Т = const необходимо приложить достаточно большое давление. Поэтому при изучении взаимной растворимости жидкостей в зависимости от температуры, давление можно считать постоянным.
Правило фаз Гиббса для систем с ограниченной взаимной растворимостью жидкостей имеет вид
С = К +1−Ф,
так как Р = const, т. е.
С = 2+1−Ф = 3−Ф.
Часто с повышением температуры взаимная растворимость жидкостей увеличивается, что приводит к сближению состава равновесных жидких фаз. Однако в некоторых случаях при повышении температуры взаимная растворимость жидкостей уменьшается. Это связано с тем, что в зависимости от природы системы теплота перехода вещества из одной фазы в другую может быть как положительной, так и отрицательной величиной.
На рис. 1 представлены различные типы фазовых диаграмм для двухкомпонентных жидких систем с ограниченной взаимной растворимостью компонентов. Из рисунка следует, что фазовые диаграммы имеют различный характер. В одном случае (рис. 1, а) кривая растворимости имеет максимум, в другом (рис. 1, б) — минимум, а в третьем случае (рис. 1, в) она представляет собой замкнутую кривую, т. е. имеет максимум и минимум. Кривые, изображенные на рис. 1, называются кривыми расслаивания.
Любая точка на диаграмме состояния системы, которая определяет состав, фазовое состояние и параметры системы, называется фигуративной точкой. На каждой диаграмме любая фигуративная точка, лежащая под кривой расслаивания, т. е. внутри области расслаивания, соответствует гетерогенной смеси жидкостей. Область, лежащая по другую сторону кривой, соответствует гомогенному
12
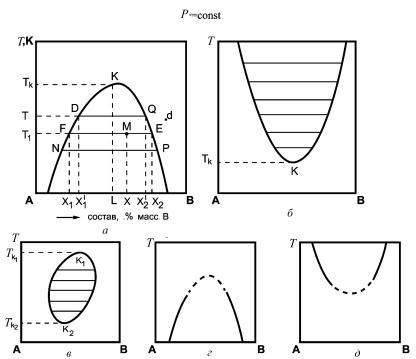
Рис. 1. Зависимость взаимной растворимости жидкостей от температуры для систем различного типа при постоянном давлении (состав выражен в % масс.)
раствору. Левые ветви кривых характеризуют растворимость компонента В, т. е. поле слева от кривой расслаивания характеризует раствор компонента В в компоненте А, поле справа — раствор компонента А в компоненте В (гомогенные системы), см., например, точку d на рис. 1, а. Для областей cлева от кривой расслаивания на фазовых диаграммах С = 2+1−1 = 2.
В гетерогенной системе внутри области расслаивания, ограниченной кривой расслаивания, составы фаз, находящихся в равновесии, определяются по правилу соединительной прямой: фигуративная точка, отображающая состав системы в целом, и точки, характеризующие составы равновесных фаз, лежат на одной прямой, параллельной оси состава системы.
13
Например, для фигуративной точки М (cм. рис. 1, а) состав всей системы в целом определяется точкой Х на оси абсцисс. Проведя линию FE параллельно оси абсцисс, получим точки F и Е, соответствующие двум равновесным жидким фазам состава Х1 и Х2. Число степеней свободы С для любой фигуративной точки, лежащей внутри области расслаивания, например точки М (см. рис. 1, а), равно С = 2+1−2 = 1.
Фигуративные точки (например, F и Е), отображающие составы двух фаз, находящихся в равновесии, называются сопряженными точками, а линии, соединяющие сопряженные точки (например, FE), называются нодами.
На рис. 1 ноды показаны горизонтальными линиями. Как видно на рисунке, по мере приближения к точкам максимума или минимума ноды становятся короче, а в точке K составы жидких слоев становятся тождественными. Точка K является критической точкой, а температура ТK, при которой составы двух равновесных жидких фаз одинаковы и компоненты полностью смешиваются между собой, называется критической температурой растворимости.
Наиболее распространены системы с верхней критической температурой растворимости (см. рис. 1, а). К ним относятся системы анилин — вода, фенол — вода, гексан — нитробензол и др. Системы триэтиламин — вода, диэтиламин — вода и другие имеют нижнюю критическую температуру растворимости
(см. рис. 1, б). В этом случае при температуре ниже критической вплоть до температуры кристаллизации жидкости смешиваются во всех соотношениях (гомогенная область). Известны также системы, обладающие как верхней, так и нижней критическими температурами растворимости: метилпиперидин — вода, никотин — вода и др. (см. рис. 1, в). Экспериментальное изучение взаимной растворимости жидкостей показало, что во многих системах не реализуются ни верхняя, ни нижняя критические температуры растворимости. В этом случае кривые расслаивания остаются незамкнутыми (см. рис. 1, г, д). Это объясняется тем, что температура кипения или температура кристаллизации смеси достигается раньше критической температуры растворимости. Опытным путем показано, что системы в критическом состоянии инвариантны, т. е.
14
в точке K при постоянном давлении значениe С = 0. Это положение полностью подтверждается термодинамикой и связано со специфическими особенностями критического состояния системы.
Для определения критической температуры растворимости В.Ф. Алексеев предложил использовать правило прямолинейного диаметра, по которому среднее арифметическое из состава равновесных жидких фаз является линейной функцией температуры (правило прямолинейного диаметра Алексеева). Это правило можно сформулировать следующим образом: середины нод, расположенные между точками, отображающими составы равновесных фаз при разных значениях температуры, лежат на одной прямой, идущей от критической точки (прямая KL на рис. 1, а).
Точка пересечения прямой KL с кривой расслаивания отвечает критической точке K, а следовательно, критической температуре растворимости.
По фазовой диаграмме можно определить состав системы и количественное соотношение фаз в любой точке. Например, в точке М (см. рис. 1, а) общий состав смеси Х , состав первой фазы — Х1, состав второй фазы — Х2, а относительные количества фаз можно определить по правилу рычага: фигуративная точка, отображающая состав всей системы, делит проходящую через нее ноду на отрезки, обратно пропорциональные массам равновесных фаз.
Для точки М , согласно правилу рычага,
mж1 |
= |
ME |
(13) |
|
|
|
, |
||
mж2 |
|
|||
|
MF |
|
||
где mж1 и mж2 — массы соответственно первой фазы (состава Х1) и второй фазы (состава Х2).
Изучение фазовых диаграмм жидкостей с ограниченной взаимной растворимостью имеет важное значение для многих областей практической деятельности, так как позволяет выбрать составы, при которых смеси жидкостей в заданных условиях не расслаиваются.
15
