
Московский государственный технический университет имени Н.Э. Баумана
Е.Е. Гончаренко, Н.М. Елисеева
АДСОРБЦИЯ ОРГАНИЧЕСКИХ КИСЛОТ
Методические указания к лабораторным работам по курсу
«Физическая и коллоидная химия»
Под редакцией А.М. Голубева
М о с к в а Издательство МГТУ им. Н.Э. Баумана
2 0 0 7
УДК 541.1 ББК 24.5
Г657
Рецензент А.Г. Андреев
Гончаренко Е.Е., Елисеева Н.М.
Г657 Адсорбция органических кислот: Метод. указания к лабораторным работам по курсу «Физическая и коллоидная химия» / Под ред. А.М. Голубева. — М.: Изд-во МГТУ им. Н.Э. Баумана, 2007. — 23 с.: ил.
Методические указания содержат описание двух лабораторных работ по разделу «Адсорбция», одна из которых выполняется в компьютерном варианте. Постановка этих лабораторных работ актуальна, так как поверхностные явления играют огромную роль в экологических процессах.
Для студентов 3-го курса специальности «Промышленная экология и безопасность» (Э-9).
УДК 541.1
ББК 24.5
© МГТУ им. Н.Э. Баумана, 2007
2
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Поверхностные явления играют огромную роль в экологических процессах и позволяют теоретически обосновать такие экологически важные проблемы, как адсорбция загрязняющих веществ на поверхности и в глубине почвы, а также распределение вредных веществ в объектах окружающей среды.
В современной технике явление адсорбции применяется по трем основным направлениям:
1)поглощение вредных примесей, осушка и очистка газов и жидкостей;
2)рекуперация, т. е. извлечение ценных веществ из отходов в целях их использования или возвращения в производственный цикл;
3)разделение газовых и жидких смесей (хроматография). Адсорбцией называется самопроизвольный процесс концен-
трирования одного из компонентов гетерогенной системы на поверхности раздела фаз. Вещество, на поверхности которого происходит адсорбция, называется адсорбентом, а компонент, который переходит из объема на поверхность фазы, — адсорбатом.
Адсорбция — самопроизвольный экзотермический процесс: G < 0; H < 0 (однако известны случаи эндотермической адсорб-
ции некоторых полимерных веществ).
Переход вещества из газовой или жидкой среды в адсорбированное состояние связан с потерей по меньшей мере одной степени свободы, что ведет к уменьшению энтропии в системе, т. е. S < 0.
В общем случае адсорбция происходит вследствие нескомпенсированности межмолекулярных сил вблизи поверхности, т. е. наличия адсорбционного силового поля.
Природа адсорбционных сил может быть различной. Если это силы Ван-дер-Ваальса, адсорбция называется физической. Если
3
адсорбция сопровождается образованием поверхностных химических соединений, она называется химической, или хемосорбцией. Отличительными чертами хемосорбции являются необратимость, высокие тепловые эффекты. Между физической адсорбцией и хемосорбцией существует множество промежуточных случаев, например, адсорбция, обусловленная образованием водородных связей. Возможны также различные типы физической адсорбции, например, она может быть вызвана электростатическими силами взаимодействия между ионами, диполями или квадруполями. При этом адсорбция определяется химической природой молекул адсорбируемого вещества и называется специфической адсорбцией.
Значительную роль при адсорбции играет также геометрия поверхности раздела: в случае плоской поверхности говорят об адсорбции на открытой поверхности, в случае слабо или сильно искривленной поверхности — об адсорбции в порах адсорбента. Поверхность, приходящаяся на один грамм адсорбента, называется удельной поверхностью. Для многих адсорбентов, в составе которых имеются поры (пористые адсорбенты), удельная поверхность может достигать тысяч квадратных метров на грамм (активированный уголь, силикагель, цеолиты и т. д.).
Для количественного описания адсорбции применяют две величины.
Абсолютная адсорбция А — это число моль или грамм адсорбата, приходящееся на единицу площади или единицу массы адсорбента. Она равна концентрации адсорбата в поверхностном слое Св, умноженной на толщину этого слоя h:
А = Свh.
Избыточная, или гиббсовская, адсорбция α — избыток числа моль или грамм адсорбата в поверхностном слое по сравнению с его количеством в объемной фазе, приходящимся на единицу площади поверхности или на единицу массы адсорбента. Избыточная адсорбция показывает, насколько увеличилась концентрация адсорбата в поверхностном слое в результате адсорбции:
α = А – Сh,
где С — равновесная концентрация в объеме.
4

Если концентрация адсорбата на поверхности намного превышает его концентрацию в объеме, т. е. Св >>С, то А = α.
Адсорбция — обратимый процесс. Одновременно с адсорбцией происходит обратный процесс — десорбция, т. е. отрыв адсорбированных молекул, обладающих повышенной энергией, от поверхности. При постоянной температуре устанавливается динамическое равновесие, которое в зависимости от внешних условий может смещаться в ту или иную сторону:
Адсорбция ↔ Десорбция.
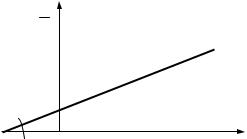
Важнейшей характеристикой адсорбционного равновесия является «изотерма» адсорбции (рис. 1), которая выражает зависимость количества адсорбированного вещества α, ммоль/мм2, от равновесного парциального давления р или равновесной концентрации адсорбата α = f(c) при постоянной температуре (Т = const).
В зависимости от условий процесса и природы адсорбента на поверхности могут образовываться адсорбционные слои толщиной в одну молекулу (мономолекулярная адсорбция), две или несколько молекул (полимолекулярная адсорбция).
При высоких концентрациях или парциальных давлениях наступает насыщение (α = α0), при котором вся поверхность адсорбента занята адсорбируемым веществом.
Первым фундаментальным уравнением «изотермы» адсорбции является уравнение Лэнгмюра, выведенное на основе следующих допущений.
1. Адсорбция происходит на активных центрах (свободных местах) поверхности, которыми являются любые дефекты кри-
сталлической структуры. Активные цен- |
|
|
|
|
тры равноценны в энергетическом отно- |
α |
|
||
шении и расположены относительно редко |
|
|
|
|
на поверхности адсорбента. |
α0 |
|
||
2. Взаимодействие |
адсорбированных |
|
|
|
молекул отсутствует. |
|
|
|
|
3. Концентрация |
активных центров |
|
|
|
одинакова в любой |
точке поверхности, |
|
|
|
|
О |
С |
||
т. е. рассматривается адсорбция на одно- |
|
|
Рис. 1 |
|
|
|
|||
родной поверхности. |
|
|
|
|
5
4. Каждый активный центр может адсорбировать только одну молекулу, в результате чего на поверхности образуется мономолекулярный слой адсорбата (α0 — емкость монослоя).
5.Адсорбированные молекулы не взаимодействуют друг с другом и не перемещаются по поверхности.
6.Наряду с адсорбцией происходит процесс десорбции.
7.Взаимодействие между молекулами адсорбата и адсорбционными центрами поверхности можно представить квазихимической реакцией:
|
Адсорбируемый |
|
Свободное место |
→ |
Локализованный |
|
|
|
|
κ1 |
|
|
газ |
+ |
на поверхности |
← |
адсорбционный комплекс |
|
|
||||
|
|
κ2 |
|||
t=0 |
P |
|
α0 |
|
0 |
p |
|
(α0 −α) |
|
α |
|
t |
|
|
|||
|
|
|
|
|
Тогда скорость адсорбции dα/dt будет равна:
dα / dt = κ1 p(α0 − α) − κ2α,
где κ1 и κ2 — константы скорости адсорбции и десорбции. При адсорбционном равновесии dα/dt = 0, т. е.
κ1 p(α0 − α) − κ2α = 0,
откуда
α = |
|
κ1 pα0 |
|
|
(1) |
||
|
|
|
. |
|
|||
|
|
κ1 p + κ2 |
|
|
|
||
Учитывая, что К = κ1/κ2 — константа адсорбционного равнове- |
|||||||
сия, разделим числитель и знаменатель уравнения (1) на κ2: |
|
||||||
α = |
(κ1 / κ2 ) pα0 |
, |
|
||||
|
|
|
|
||||
1 + (κ1 / κ2 ) p |
|
||||||
или |
|
|
|
||||
α = |
Кpα0 |
, |
|
|
(2) |
||
|
|
|
|||||
|
|
1 + Кp |
|
|
|
||
где α0 — предельное количество адсорбированного вещества в плотном монослое; р — равновесное парциальное давление адсорбируемого вещества.
Уравнение (2) — уравнение «изотермы» Лэнгмюра.
6

Величина θ = α/α0 называется степенью заполнения поверхности. Разделив левую и правую части уравнения (2) на α0, получим
уравнение Лэнгмюра в виде
θ = |
Кp |
. |
(3) |
|
|||
1+ Кp |
|
||
Уравнение Лэнгмюра иногда выражают через адсорбционные коэффициенты а и b.
Обозначив в уравнении (4) a = Кα0; b = К, получим еще одну форму уравнения Лэнгмюра:
α = |
аp |
. |
(4) |
|
|||
1+ bp |
|
||
Из уравнения (4) следует:
1) при р → 0 bp << 1 — получаем уравнение «изотермы» Генри
α = аp, |
(5) |
которое описывает начальный линейный участок «изотермы» — см. рис. 1 (а — коэффициент Генри);
2) при р → ∞ bp >> 1, α = a/b= α0, т. е. достигается насыщение поверхности.
Уравнение Лэнгмюра в виде (2)–(4) применимо также и к адсорбции из растворов. Если вместо давления газа р подставить в уравнение (2) концентрацию растворенного вещества С, то уравнение примет форму
КС |
(6) |
α = α0 1+ КС . |
Для нахождения констант α0 и К уравнение (2) или (6) преобразуют следующим образом:
1 1 1
=+
αα0КС α0
или
С |
= |
1 |
+ |
С |
. |
(7) |
|
α0К |
|
||||
α |
|
α0 |
|
|||
7
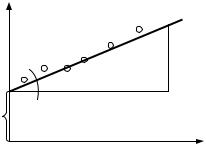
В координатах [C/α – C] уравнение (7) соответствует прямой (рис. 2).
Тогда α0 = ctg β, а отрезок, отсекаемый на оси ординат, равен |
1 |
. |
|||||||||
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
Кα0 |
|
Уравнение Лэнгмюра позволяет рассчитать площадь поверхно- |
|||||||||||
сти адсорбента S, если известна площадь W0, занимаемая молеку- |
|||||||||||
лой в плотном монослое: |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
S = NAα0W0, |
||||
где NA — число Авогадро. |
|
|
|
|
|
||||||
|
|
С |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
α |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
С |
|||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
α |
|||
|
|
|
|
|
|
β |
|
|
|
|
|
1 |
|
|
|
|
С |
||||||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
||
|
Кα0 |
|
|
|
|
|
|||||
|
|
|
|
|
|
||||||
|
|
|
О |
|
|
С |
|||||
|
|
|
|
|
|
|
Рис. 2 |
||||
|
|
|
|
|
|
|
|||||
В случае адсорбции на границе «раствор — твердая фаза» применение адсорбентов с большой удельной поверхностью приводит к столь значительной адсорбции, что изменение концентрации вещества в объеме может быть определено аналитически. В этом случае адсорбцию α, отнесенную к единице массы m адсорбента (поверхность которого обычно известна), находят по разности концентраций:
α = |
x |
|
(C0 − C)V |
, |
(8) |
|
|
||||
|
m m |
|
|||
где х — число моль адсорбированного вещества; m — масса адсорбента, г; С0 — концентрация раствора до адсорбции; С — концентрация после адсорбции; V — объем раствора.
В ряде случаев для описания адсорбции веществ из растворов применимо эмпирическое уравнение «изотермы» Фрейндлиха. На
8
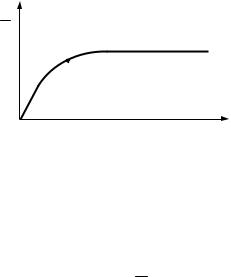
рис. 3 представлена экспериментальная «изотерма» адсорбции. При малых концентрациях растворенного вещества (участок Оа) наблюдается линейная зависимость, т. е. выполняется закон Генри. При больших концентрациях (участок bd) происходит насыщение поверхности. В области средних концентраций (участок ab) применимо эмпирическое уравнение Фрейндлиха:
|
x |
′ |
n |
, |
(9) |
|
|
||||
|
|
|
|||
α = = К C |
|
||||
m
где х/m — количество адсорбированного вещества на единицу массы адсорбента, моль; К′ — константа, представляющая собой количество адсорбированного вещества при равновесной концентрации, равной единице; С — равновесная концентрация; n — константа, определяемая экспериментально.
x
m
d
b
 a
a
О |
С |
|
Рис. 3
Для нахождения констант К′ и n уравнение Фрейндлиха логарифмируют:
lg α = lg |
x |
= lg К′ + nlg С, |
(10) |
|
m
затем строят график зависимости lg x от lg C (рис. 4). m
Отрезок ОА, отсекаемый прямой на ординате, дает значение lg К′, а тангенс угла наклона к оси абсцисс равен n ( tg β = n ).
Теория адсорбции получила развитие в работах Б.В. Ильина, М. Поляни, Р. Зигмонда, М.М. Дубинина и других ученых. В част-
9
ности, С. Брунауэр, П. Эммет, Э. Теллер сделали попытку создания единой теории физической адсорбции на однородной поверхности, рассматривая процесс адсорбции паров как образование на поверхности полимолекулярных слоев. «Изотерма» адсорбции, выведенная с учетом сил взаимного притяжения между молекулами адсорбированного вещества, называется уравнением БЭТ (Брунауэра — Эммета — Теллера):
p / ps |
= |
1 |
+ |
(C −1) p |
, |
(11) |
|
|
|
||||
α(1 − p / ps ) |
|
α0C α0Cps |
|
|||
где рs — давление насыщенного пара жидкости; С — константа, С = К1/КL (К1 — константа равновесия; КL — константа конденсации пара в жидкость).
lg x m
A
β
О |
lgC |
Рис. 4
Теория полимолекулярной адсорбции постулирует, что при температуре ниже критической каждая молекула, адсорбированная в первом слое, является центром для молекул, образующих второй слой, и т. д. При этом считается, что теплота адсорбции Q во всех слоях, кроме первого, равна теплоте конденсации λ.
Константу С можно выразить уравнением
Q − λ |
|
||
C = exp |
|
. |
(12) |
|
|||
RT |
|
|
|
Уравнению (12) в координатах |
[α |
– р/рs] соответствует |
|
S-образная кривая.
10
Широкое распространение теории БЭТ связано с тем, что ее авторы, фактически считая адсорбцию нелокализованной, отождествляют константу α0 не с числом дискретных адсорбционных центров, а с числом молекул адсорбата в первом слое при плотнейшей упаковке (при p = ps). Поэтому, вводя представление о площади W0, занимаемой одной молекулой в этом слое, принимают:
S = α0W0NА, |
(13) |
где S — площадь поверхности.
Как правило, для определения удельной поверхности измеряют «изотерму» адсорбции азота, считая, что площадь, занимаемая молекулой азота в плотном монослое, W0 = 0,162 нм.
Существует еще один механизм, приводящий к дополнительной адсорбции веществ, имеющих температуру ниже их критической температуры, на пористых адсорбентах при сравнительно высоких значениях р/рs. Это — капиллярная конденсация. Если в поре образовался вогнутый мениск адсорбата, то в ней начинается конденсация при р/рs < 1.
Согласно уравнению Кельвина
RT ln |
p |
= |
2σV |
, |
(14) |
|
|
ps r
где σ — поверхностное натяжение адсорбата; V — его молярный объем; r — радиус кривизны мениска.
Капиллярная конденсация приводит к резкому подъему «изотермы» адсорбции.
Процесс капиллярной конденсации обычно используют для определения размеров пор адсорбента. Для этого по уравнению (14) для каждого значения р/рs вычисляют радиус кривизны мениска и линейный размер (эффективный радиус rэф) пор, заполняемых при данном значении р/рs. Метод применим при rэф ≥ 1,5 мм.
Дальнейшее развитие теория адсорбции получила в работах М. Поляни, предложившего потенциальную теорию адсорбции, в соответствии с которой вблизи поверхности адсорбента существует потенциальное силовое поле, убывающее с удалением от поверхности. Однако эта теория экспериментально подтверждалась лишь приближенно для тонкопористых адсорбентов.
11
