
Используя модель М. Поляни, М.М. Дубинин разработал теорию объемного заполнения микропор (ТОЗМ), применимую к микропористым адсорбентам. По этой теории весь объем пор «занят» адсорбционным полем, поэтому при адсорбции они заполняются не послойно, а объемно. Теория ТОЗМ используется в физи- ко-химических исследованиях с микропористыми адсорбентами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Лабораторная работа «Адсорбция сульфосалициловой кислоты на активированном угле»
Цель работы — используя экспериментальные данные, построить «изотерму» адсорбции сульфосалициловой кислоты на активированном угле и выяснить применимость уравнений Лэнгмюра или Фрейндлиха для описания процесса.
Порядок выполнения работы
В этой работе равновесную концентрацию кислоты после адсорбции определяют методом кондуктометрического титрования.
При этом используют компьютер с измерительным блоком, датчик электропроводности, датчик объема жидкого реагента.
Для выполнения работы необходимо следующее.
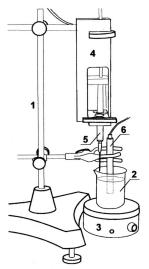
1. Собрать установку для кондуктометрического титрования в соответствии с рис. 5 (1 — штатив; 2 — стакан; 3 — магнитная мешалка; 4 — датчик объема жидкого реагента; 5 — шприц; 6 — датчик электропроводности). К первому разъему измерительного блока подключить датчик электропроводности, ко второму — датчик объема жидкого реагента. Датчик электропроводности установить
Рис. 5 на диапазон измерений 0…1 мОм/см.
12
2. Построить калибровочную кривую, которая представляет собой зависимость электропроводности раствора от концентрации сульфосалициловой кислоты.
Для проведения эксперимента нужно:
а) присоединить к датчику объема жидкого реагента шприц (10 мл), заполненный 0,1 М раствором кислоты (поршень шприца должен войти до упора в толкатель датчика так, чтобы на кончике иглы шприца появилась капля раствора);
б) в стакан на 100 мл налить 80 мл дистиллированной воды и включить магнитную мешалку;
в) в меню программы «L — Химия — Практикум» выбрать сценарий «Титрование» с контролем одного параметра → «Кондуктометрическое» с диапазоном (0 — 1) → «Автоматическое определение объема титранта» → «Настройка оборудования»: V = 10 мл, l = 49 мм;
г) нажать на экране кнопку «Пуск» и включить процесс измерения, затем — кнопку «Выбор». Таким образом вводится результат измерения электропроводности дистиллированной воды;
д) вращая рукоятку датчика объема, постепенно добавлять в стакан по 0,1…0,2 мл кислоты. При добавлении каждой порции кислоты необходимо подождать 2…3 мин до стабилизации показаний электропроводности, после чего нажать на экране кнопку «Выбор» и ввести значение электропроводности при данном объеме. Кислоту добавлять до тех пор, пока ее электропроводность не достигнет значения 1 мОм/см;
е) остановить измерения, нажав на экране кнопку «Архив».
3. После проведения опыта построить калибровочный график и приблизить его к функции вида
С = АκB,
где С — концентрация кислоты; κ — электропроводность; А и B — параметры калибровочной зависимости (см. ниже раздел «Обработка результатов»).
Для построения калибровочного графика необходимо:
а) открыть файл с зависимостью электропроводности от концентрации кислоты (в нем в первом столбце ввести объем добавленного раствора кислоты, во втором — значение электропроводности при данном объеме);
13

б) скорректировать значение электропроводности в каждой точке, учитывая фон, т. е. для каждой точки вычесть значение электропроводности дистиллированной воды (значение электропроводности в первой точке);
в) для всех точек рассчитать концентрацию кислоты в растворе по формуле
CС0кVк
к= V0 +Vк ,
где С0к = 0,1 М ― концентрация кислоты, которую добавляют в воду; Vк — объем добавленной кислоты; V0 = 80 мл (объем воды в стакане);
г) построить зависимость концентрации кислоты Ск от скорректированной электропроводности и аналитически приблизить ее к функции вида
Ск = АκB,
где А и B — параметры калибровочной кривой.
д) подобрать параметры А и B, преобразовав уравнение в линейную форму:
lg Cк = lg A + Blg κ .
Определив значения А и В из полученной прямой методом подбора, по значению электропроводности рассчитать концентрацию кислоты Ск. Найденные значения нанести на график рядом с экспериментальными точками и провести кривую. Если расчетная кривая заметно отклоняется от экспериментальной, уточнить значения параметров А и В. Перебирая А и В, добиться того, чтобы сумма квадратов отклонений была минимальной.
4. Провести опыт по адсорбции сульфосалициловой кислоты. Для этого необходимо:
а) в стакан на 100 мл налить 80 мл дистиллированной воды (перед экспериментом стакан и щуп нужно ополоснуть дистиллированной водой и тщательно протереть фильтровальной бумагой); б) заполнить шприц 0,1 М раствором сульфосалициловой ки-
слоты и присоединить его к датчику объема жидкого реагента; в) в стакан с водой положить одну таблетку активированного
угля, включить магнитную мешалку и размешать уголь до измель-
14

чения. Затем опустить датчик электропроводности и, нажав на экране кнопку «Пуск», включить процесс измерения. После того как значения стабилизируются, нажать на экране кнопку «Выбор» и ввести значение электропроводности;
г) вращая рукоятку датчика объема, добавлять в стакан по 0,1…0,2 мл кислоты и фиксировать кнопкой «Выбор» стабильные значения электропроводности. Измерения продолжать до тех пор, пока электропроводность не достигнет значения 1 мОм/см;
д) остановить измерения, нажав на экране кнопку «Стоп», и сохранить их, нажав кнопку «Архив».
5. По калибровочной кривой с подобранными значениями параметров А и В рассчитать равновесную концентрацию кислоты в
растворе после адсорбции ( Cкр ).
6. Вычислить количество адсорбированной кислоты α на единицу массы адсорбента:
α = Сα (V0 +Vк ) , m
где Cα — разность аналитической ( Cк ) и равновесной ( Cкр ) концентраций кислоты.
7. Построить изотерму адсорбции в координатах α =ƒ( Cкр ). Для построения изотермы адсорбции открыть файл, получен-
ный при добавлении кислоты. В нем три столбца: в первом нужно ввести объем добавленного раствора кислоты, во втором — значение электропроводности раствора при данном объеме добавленной кислоты, в третьем — время от начала эксперимента (данные третьего столбца носят информативный характер и не используются при обработке).
8. Вычислить значение Cкр / α. Построить график зависимости
Cкр / α = ƒ( Cкр ) и определить константы уравнения Лэнгмюра α0 и К (см. «Теоретическую часть»). Сделать вывод о применимости уравнения Лэнгмюра для описания процесса.
9. Построить график зависимости lg α = ƒ(lg Cкр ) и определить константы уравнения Фрейндлиха К и n. Определить, какое из двух уравнений, Лэнгмюра или Фрейндлиха, лучше описывает процесс?
15
Обработка результатов
После проведения эксперимента данные нужно записать в текстовый документ.
Для перевода данных в Excel требуется поменять все точки в десятичных дробях на запятые. Затем скопировать значения из текстового файла с данными первого эксперимента в файл «Адсорбция сульфосалициловой кислоты углем_шаблон_студентам», выделить их и щелкнуть правой кнопкой мыши. В выпадающем меню выбрать команду «Копировать». Включить программу Excel. Открыть файл «Адсорбция сульфосалициловой кислоты углем_шаблон_студентам», нажав на главной панели кнопку «Файл».
В выпадающем меню выбрать команду «Открыть». Найти данный файл. Во второй таблице найти графу «Начальный объем». Щелкнуть правой кнопкой мыши на первой ячейке этой графы и в выпадающем меню выбрать команду «Вставить». Графы «Начальный объем» и «Электропроводность» заполнить начальными данными. В первую таблицу, находящуюся в левом верхнем углу экрана, записать концентрацию кислоты и объем жидкости, налитой в мерный стакан. Чтобы скорректировать начальные данные, нужно вычесть из начальных значений электропроводности и объема фоновые значения, приняв за фон результаты второго измерения. В программе Excel для выполнения операций над числовыми значениями, записанными в некоторых ячейках, и записи результата в другую ячейку используются формулы, связывающие эти ячейки. (Каждая ячейка имеет свой номер, состоящий из буквенного и численного обозначения, например: L9.) Для этого следует нажать на первую ячейку третьей графы (если не считать графу с номером измерения) и ввести формулу: =B9-$B$9.
Для самостоятельного написания формул нужно знать следующее:
а) сначала ОБЯЗАТЕЛЬНО ставится знак равенства: =; б) для выполнения операций над числовыми значениями нуж-
но оперировать номерами ячеек, в которых они находятся; в) для удобства, чтобы не вводить заново формулу в каждой
строке одной графы, нужно навести мышью на правый нижний угол первой ячейки, в которой уже введена формула (курсор примет вид черного крестика), и, зажав левую кнопку мыши, протя-
16

нуть столбец вниз до последней строки. При этом в формулах в ячейках столбца, следующих за первой, номера будут увеличиваться на единицу. Чтобы зафиксировать номер какой-либо ячейки, в формуле перед буквенным, а также перед численным её обозначением нужно ввести знак $.
Для примера напишем формулу в первой и второй ячейках третьей графы «Начальный объем, учитывая фон»: =B9-$B$9, =B10-$B$9.
Описанным выше способом вводят формулы в третий и четвертый столбцы, как уже отмечалось, вычитая из каждой ячейки фоновые значения.
Для нахождения концентрации кислоты Ск нужно ввести формулы для пересчета в ячейки соответствующей графы, пользуясб фломулой
Cк = С0кVк 1000.
V0 + Vк
Затем в последних двух столбцах следует пересчитать значения десятичных логарифмов электропроводности (К) и концентрации (Ск). (Функция десятичного логарифма в Excel — LOG(Значение), степень — основание степени^показатель.)
В третьей таблице, находящейся под первой, ведется расчет коэффициентов А и В калибровочной кривой.
Для нахождения lgA нужно использовать функцию «ОТРЕЗОК (\диапазон y\;\диапазон x\)». Ее вводят в соответствующей ячейке как формулу, в скобках указывая диапазоны ячеек lgСк и lgК. Далее нужно рассчитать коэффициент A. Для нахождения параметра В используют функцию «НАКЛОН (\диапазон y\;\диапазон x\)». Ее вводят в соответствующей ячейке как формулу, в скобках указывая диапазоны ячеек lgСк и lgК (НАКЛОН (A1:A6;B1:B6;)).
Калибровочный график строят по данным, занесенным во вторую и третью таблицы.
Для построения калибровочного графика самостоятельно нужно выполнить определенную последовательность действий:
а) на панели инструментов выбрать команду «Мастер диаграмм»; б) в диалоговом окне (шаг 1) выбрать тип диаграммы — «Точечная», далее выбрать вид диаграммы — последний в первом
столбце — и нажать «Далее»;
17

в) в диалоговом окне (шаг 2) выбрать вкладку «Ряд». Найти в конце строки «Значения х» знак с красной стрелкой и после нажатия на нее выбрать диапазон ячеек, значения которых соответствуют значениям х (в данном случае это ячейки электропроводности), найти в конце строки «Значения y» знак с красной стрелкой и после нажатия на нее выбрать диапазон ячеек, значения которых соответствуют значениям y (в данном случае это ячейки концентрации).
Вчетвертую таблицу, находящуюся справа, в первые два столбца следует занести данные, полученные во втором эксперименте, т. е. значения объема и электропроводности.
Втретьем столбце нужно вычислить скорректированную с учетом фона электропроводность (фоном считается первое измерение).
Вчетвертом столбце вычислить аналитическую концентрацию
кислоты (Ск), пользуясь формулой Cк |
= |
С0кVк |
и не забыв умно- |
|
|||
|
V +V |
||
|
|
0 к |
|
жить это выражение на 1000 (С0к и V0 — исходные данные, занесенные в первую таблицу). В следующем столбце рассчитываются значения равновесной концентрации кислоты на основании значений электропроводности с подобранными коэффициентами А и В
по формуле Cкр = АκВ, где κ — электропроводность.
В следующем столбце следует рассчитать концентрацию адсорбированной кислоты (Сα) как разность аналитической (Ск) и равновесной (Cкр ) концентраций кислот. В последнем столбце вычисля-
ется количество адсорбированной кислоты α на единицу массы сорбента по формуле
α = Cα (V0 +Vк ) . m
В следующих столбцах нужно рассчитать отношение Cкр /α, а также логарифмы α и Cкр .
При оформлении работы требуется построить графики: 1) α =ƒ( Cкр ) — «изотермы» адсорбции; 2) Cкр / α = ƒ( Cкр ); 3) lgα = = ƒ( Cкр ), а также определить константы уравнения Лэнгмюра α0 и К и константы уравнения Фрейндлиха К1 и n.
18
