
Гетерогенно - каталитические процессы
.pdfФ Е Д Е РАЛ Ь Н О Е АГ Е Н Т С Т В О П О О БРАЗО В АН И Ю
М иттоваИ .Я., С ухочевА.С ., М ещеряковаЕ .К.
Гетерогенно-каталитическиепроцессы
Учеб ноепособ ие
ВО РО Н Е Ж
2006
2
У тверж дено Н аучно-м етодическим советом хим ического ф акультета протокол№ 9 от19.05.2006 года
Д Н М .В .02.1У чеб ноепособ иеподготовлено накаф едренеорганической хим ии хим ического ф акультетаВ оронеж ского государственного университета
Реком ендуется для м агистровхим ического ф акультетапервого годаоб учения
Д ля специальности 020100 (510500) – Х им ия
3
О С Н О ВН Ы Е О П Р Е Д Е Л Е Н И Я
К атализ и к атализато ры . Катализом (от греч. « katalysis» — разруш ение) называют изм енениескорости хим ической реакции при воздействии веществ— катализаторов, которыеучаствуют в реакции, но невходят всоставконечных продуктов. Катализатор не находится в стехиом етрическом отнош ении с продуктам и и, какправило, регенерируется послекаж дого циклапревращений реагентоввпродукты. В б ольш инствеслучаевколичество катализатора м ного
м еньш е количества реагентов. |
Н априм ер, |
1 г |
Pt-катализатора |
вызывает |
|
превращение104 гSO2, при окислении вSO3 или 106 гNH3 при окислении вNO. |
|||||
Различают п оложит ель н ы й |
кат ализ, когдакатализаторускоряет реакцию, |
||||
и от рицат ель н ы й , когда катализатор зам едляет |
реакцию. В б ольш инстве |
||||
случаев под |
терм ином « катализ» поним ают |
полож ительный |
катализ. |
||
О трицательные |
катализаторы |
называют |
такж е |
антикатализаторам и, или |
|
ингиб иторам и. О днако влитературем ож но встретить определениеингиб итора как вещества, торм озящего только цепные реакции, т.е. вещества, об рывающего цепь. Явление ускорения реакции при воздействии продукта реакции или одного из пром еж уточныхвеществназывают авт окат ализом .
С уществуют |
такж е |
определения |
катализа, |
включающие |
в себ я |
дополнительные |
указания: во-первых, |
на хим ическую неизм еняем ость |
|||
катализатора во |
врем я |
реакции, во-вторых, на |
хим ический |
характер |
|
пром еж уточного |
взаим одействия реагентов с катализатором , в-третьих, на |
||||
м ногократность этого взаим одействия. В б ольш инствеслучаевэти дополнения правильно отраж ают специф ику явления катализа. О днако для проверки этих полож ений зачастую необ ходим ы дополнительныеисследования.
Е сли катализатор и реагирующие вещества находятся в одной и той ж е ф азе, кат ализ называют гом оген н ы м . В этом случае катализатор равном ерно распределен по реакционном у об ъем у ватом ноили м олекулярно-дисперсном
состоянии. К процессам |
гом огенного |
катализа относят |
м ногочисленные |
|
реакции |
гидратации, |
гидролиза, |
сульф ирования, |
галогенирования, |
этериф икации, конденсации и другие, ускоряем ыекислотам и или основаниям и вж идкой ф азе.
Е сли катализатор и реагирующие вещества находятся в разных ф азах, м еж ду которым и им еется граница раздела, кат ализ называют гет ероген н ы м . Н аиб олеераспространен случай, когдатвердый катализатор(контакт) ускоряет
реакцию м еж ду газам и или реакцию в растворе. |
Г етерогенно-каталитические |
|
процессы в пром ыш ленности используют |
ш ире, чем |
гом огенно- |
каталитические. К ним относят важ нейш иепром ыш ленныереакции синтеза и окисления ам м иака, окисления SO2 вSO3, глуб окого и парциального окисления
органических соединений, получения водорода конверсией см еси С О |
+ H2O |
||
или С Н 4 + Н 2О , крекингаи риф орм инганеф ти, атакж ем ногиедругие. |
кат ализ |
||
П ром еж уточное |
полож ение |
заним ает микрогет ероген н ы й |
|
коллоидным и или |
полим ерным и |
частицам и. К этом у классу |
относят |
б иохим ическиепроцессы вж ивыхорганизм ах, катализируем ыеорганическим и б елковым и б иокатализаторам и — ф ерм ентам и (энзим ам и).
Г ет ероген н о-гомоген н ы м кат ализом называют процессы, начинающиеся
(инициируем ые) на поверхности твердого катализатора и далее
4
продолж ающиеся в газовой или ж идкой ф азе за счет вылета с поверхности
активных пром еж уточных частиц. |
В |
этом случае катализатор инициирует |
начальное превращение реагента, |
а продолж ение цепи происходит б ез его |
|
участия. О б ычно это экзотерм ическиерадикально-цепныереакции. |
||
П ро мо то ры . П ром оторам и, |
или |
активаторам и называют вещества, |
доб авлениекоторыхккатализатору |
увеличиваетего активность, селективность, |
|
устойчивость. Е сли пром отор доб авляют к катализатору в б ольш их количествах, такой кат ализат ор называют смешан н ы м . Какправило, действие см еш анныхкатализаторовнеаддитивно, т.е. активность его нельзя представить
как сум м у |
активностей |
составляющих его ком понентов. |
Е сли каж дый из |
|
ком понентов слож ного катализатора повыш ает активность в см еси, |
говорят о |
|||
синергизм е |
действия |
ком понентов катализатора. |
Г раницу |
м еж ду |
пром отированным и и см еш анным и катализаторам и зачастую провести трудно.
О б ычно, если доб авка составляет проценты и доли процентов, |
ее относят к |
|||
пром оторам . |
Больш инство |
пром ыш ленных катализаторов |
являются |
|
пром отированным и. Н априм ер, |
ж елезный катализатор синтеза |
ам м иака |
||
содерж ит в качествепром оторов Al2O3, К2О , иногда такж е С аО |
в количестве |
|||
нескольких |
процентов. Ф ункции этих пром оторов различны: |
Аl2О 3 — |
||
структурооб разующая доб авка, увеличивающая удельную поверхность ж елеза
и препятствующая спеканию кристалликов ж елеза; |
К2О — активирующая |
|
доб авка, повыш ающая активность каталитических |
центров |
ж елеза или |
создающая новыеактивныецентры. |
|
|
К аталитическ ие яды (контактные яды) — это |
вещества, |
воздействие |
которыхнакатализаторприводит кум еньш ению его активности или кполном у подавлению каталитического действия. Каталитическим и ядам и во м ногих реакцияхнам еталлическихкатализаторахявляются, наприм ер, кислород и его соединения (Н 2О , С О и др.), авсинтезеам м иака— соединения серы (Н 2S, CS2).
В стречаются такж еслучаи, когдаоднаи таж едоб авкаккатализатору при одних концентрациях и тем пературах является пром отором , а при других —
каталитическим |
ядом . Т акую доб авку называют м одифицирующей добавкой , а |
сам о явление— |
м одифицирован ием . |
Н о сители. |
Н осители — это вещества, сам и по себ е неактивные или |
м алоактивные, |
нанесение на них катализатора значительно повыш ает его |
активность. В простейш ем случаедействиеносителя заключается вувеличении поверхности раб отающего катализатора и в предохранении его от спекания. П оэтом у в качестве носителя прим еняют твердые тела с высокоразвитой поверхностью — как искусственные (активные угли, SiO2, Al2O3, алюм осиликаты, MgO), таки естественные(природныеглины, пем за, диатом ит,
асб ест и др.). В некоторых случаях носитель |
способ ствует стаб илизации |
|
определенной хим ической ф орм ы катализатора. |
|
|
О пределен ие ак тивн о сти, селек тивн о сти, |
элемен тарн о го |
ак та. Д ля |
определения кат алит ической акт ивн ост иваж ным |
является вопрос: к каком у |
|
количеству катализатора относить каталитическую активность. |
Ч аще всего |
|
каталитической активностью называют скорость реакции, отнесенную к единицем ассы катализаторат
5
|
A |
= |
|
1 |
|
dp |
= |
r |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
m |
|
|
|
|
m dt |
|
|
|
|
m |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
или кединицеоб ъем акатализатораVK |
dp = |
|
|
r |
|
|
|
|
|
|
|
|||||||||||||
|
r = |
1 |
|
|
|
|
. |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
v |
VK dt |
VK |
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
П осле того как научились изм ерять удельную поверхность дисперсных |
||||||||||||||||||||||||
тел, активность стали относить к1 м 2 поверхности (S) и назвали эту величину |
||||||||||||||||||||||||
удель н ой кат алит ической акт ивн ост ь ю (У КА). |
|
|
|
|
|
|
||||||||||||||||||
|
r |
= |
1 |
dp = |
r |
. |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
s |
|
|
|
S dt |
|
|
S |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Д альнейш ее развитие науки |
|
о |
|
катализе позволило |
|
в |
ряде случаев |
|||||||||||||||||
определить число активных центров (N) на поверхности. М |
|
. Будар предлож ил |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
–1 |
) |
(turnover number), |
|||
прим енять в катализе понятие « число об оротов» t.n. (с |
||||||||||||||||||||||||
ранее прим ененное к ф ерм ентативном у |
катализу. О но |
представляет соб ой |
||||||||||||||||||||||
число каталитических актов на одном |
активном центревсекунду при данных |
|||||||||||||||||||||||
тем пературе, давлении, отнош ении реагентов, степени превращения |
|
|||||||||||||||||||||||
|
t.n. = |
1 |
|
dp |
= |
|
r |
, |
|
|
|
|
|
|
||||||||||
|
N dt |
N |
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
гдеN — число активныхцентров(см –2). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
П онятие « число |
об оротов» |
позволяет |
|
достаточно |
просто |
сравнивать |
||||||||||||||||||
активность разных катализаторов, хотя |
|
|
всегда им еются |
трудности в |
||||||||||||||||||||
определении N. М ногие исследователи |
|
|
отм ечают, |
что |
|
для |
б ольш инства |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
–2 |
|
|
2 |
–1 |
|
|
каталитическихреакций t.n. находится винтервале10 |
— 10 |
с . П ри высоком |
||||||||||||||||||||||
давлении изм еряем ыезначения t.n. б ольш е, апри низком |
давлении — |
м еньш е. |
||||||||||||||||||||||
Селект ивн ост ь ю |
(С) называют отнош ение скорости данной |
реакции к |
||||||||||||||||||||||
сум м ескоростей всехреакций, протекающих наданном |
катализаторевтехж е |
|||||||||||||||||||||||
условияхсучастием реагентов |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C= r / åri .
Естественно, величины r долж ны б ыть выраж ены в одних и тех ж е единицах. С елективность изм еряется впроцентахпо отнош ению ксум м арном у превращению.
О дной из важ нейш их характеристик протекания хим ической реакции
является ст еп ен ь п ревращен ия, или кон версия (X). О на выраж ает долю (в %)
об разующегося |
продукта реакции |
по отнош ению |
к исходном у веществу |
|
(реагент). В |
технологических |
раб отах и в |
раб отах практической |
|
направленности |
часто |
прим еняют |
понятие «вы ход» (В). В ыходом (в %) |
|
называют количество |
целевого продукта, об разующегося в результате всей |
|||
сум м ы операций в реакторе и отнесенное к количеству поступающего сырья
(реагента). В б ольш инстве случаев В = ХС и м еньш е 100%. В |
некоторых |
случаях (в неф теперераб отке) принято изм ерять нем ассу, а об ъем |
продуктов. |
П оэтом у, если плотность продуктовм еньш еплотности реагентов, выход м ож ет ф орм ально превыш ать 100%.
Зависим ость константы скорости каталитической реакции, как и некаталитической, от тем пературы подчиняется уравнению Аррениуса
6
k = k0 exp(–E/RT),
где k0 — предэкспоненциальный м нож итель или частотный ф актор, Е — энергия активации вккал/м оль или кД ж /м оль.
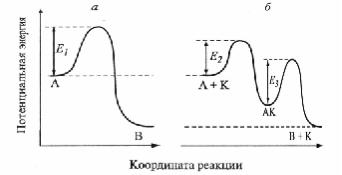
|
Э нергия |
|
активации |
|
|||
каталитической реакции, как |
|
||||||
правило, |
м еньш е, |
чем |
|
||||
некаталитической. |
С ниж ение Е |
|
|||||
об ъясняется тем , |
|
что |
при |
|
|||
катализе реакция протекает по |
|
||||||
новом у пути, складывающем уся |
|
||||||
из |
элем ентарных |
|
хим ических |
|
|||
реакций |
(стадий), |
энергия |
Рис. 1. Э нергетическая диаграм м ареакций А → |
||||
активации которых E2, E3 и т. д. |
|||||||
ниж е, чем |
энергия активации Е1 |
В , а — б ез катализатора, б — вприсутствии |
|||||
некаталитической реакции (рис. |
катализатораК, E1 – E2 — соответствующие |
||||||
значения энергии активации |
|||||||
1). |
И зоб раж енная |
на рис. |
1,б |
||||
схем а соответствует ст адий н ом у м ехан изм у катализа, когда одностадийная реакция (рис. 1,а) А → В зам еняется совокупностью стадий; в простейш ем случаеэто А + К → АК, АК → В + К, гдеК — катализатор. Каж дая из этих стадий протекаетсм еньш им и энергиям и активации, какпоказано нарис. 1,б.
В |
отличие от м ногостадийных существуют одностадийные («слит н ы е», |
|||
или «ассоциат ивн ы е») каталитическиепроцессы, протекающиепо схем е |
||||
|
|
|
А + В + К → (АВ К)* → С + D + К, |
|
где |
(АВ К)* |
— |
пром еж уточный, или « активированный» , |
ком плекс, |
находящийся |
на |
верш ине потенциального б арьера. В этом |
случае |
|
каталитическая реакция протекает через один потенциальный б арьер, каки на рис. 1,а, но с пониж енным значением Е. С ниж ение энергии активации при катализе является основной причиной ускорения каталитических реакций по
сравнению снекаталитическим и. |
|
|
||
Элем ен т арн ы й |
акт (элем ен т арн ая |
ст адия) реакции — |
реакция, |
|
изм енение состояния систем ы |
с переходом |
в другое состояние, |
треб ующее |
|
преодоления не б олее одного |
потенциального б арьера. Н а рис. |
1,б реакция |
||
состоит из двух |
элем ентарных стадий. |
Э лем ентарную стадию принято |
||
записывать на м олекулярном уровне. Н априм ер, диссоциативную адсорб цию водороданадвухсоседнихатом ахМ м еталлам ож но написать ввиде:
Н 2 + 2М Ђ |
2Н — М . |
С корость данной элем ентарной стадии равна разнице скоростей прям ой |
|
(rs) и об ратной (r–s) реакций r = rs –r–s. |
1) об ратная реакция описывается той |
Н а потенциальной кривой (см . рис. |
|
ж е координатой, что и прям ая реакция, |
но в противополож ном направлении. |
П ри этом систем а проходит через один и тот ж епотенциальный б арьер, хотя затратаэнергии для его преодоления б удет разной, потом у что уровни энергии исходныхвеществ(и продуктовреакции) впрям ой и об ратной реакцияхб удут разные. Разность энергий активации об ратной (E–s) и прям ой (Es) элем ентарных реакций, если прям ая реакция — экзотерм ическая, а об ратная — эндотерм ическая, равнатеплоте(Q) этой элем ентарной стадии.
E–s –Es = Q.
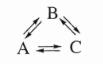
|
8 |
|
|
|
К АТАЛ И ЗИ ТЕ Р М О Д И Н АМ И К А |
|
|
В се |
каталитические процессы в терм одинам ическом отнош ении — |
||
сам опроизвольные процессы, т.е. сопровож даются ум еньш ением |
своб одной |
||
энергии |
G. Катализатор не сдвигает полож ения |
равновесия |
хим ической |
реакции, |
если не считать возм ож ности косвенного |
влияния катализатора на |
|
коэф ф ициенты активности реагирующихвеществврастворахили при высоком
давлении в газовой ф азе. В б лизи от равновесия реакции А Ђ |
В |
катализатор |
|
ускоряет прям ую реакцию А → |
В и об ратную реакцию В |
→ |
А в равной |
степени. |
|
|
|
Константа равновесия (K) |
при данной тем пературе |
однозначно |
|
определяется изм енением своб одной энергии G = RTlnK. |
|
|
|
В соответствии с законом |
действующих м асс константа равновесия |
||
реакции K равнаотнош ению констант скорости прям ой реакции (kA) и об ратной реакции (kB)
K= kA/kB.
Отсюда следует, что, если катализатор увеличивает константу скорости
прям ой реакции kA, он в такой ж е степени увеличит константу kB об ратной реакции.
Н а практике для прям ой и об ратной реакций часто прим еняют разные катализаторы. Т ак, каталитическое дегидрирование циклогексана и об ратная ем у реакция гидрирования б ензола
|
|
|
|
С 6Н 12 Ђ |
С 6Н б + 3Н 2 |
|
|
|
|
|
|
|
||
протекают сб лизким и скоростям и при –250 °С наодном |
и том |
ж екатализаторе |
||||||||||||
Pt/Al2O3. Г идрирование б ензола в циклогексан |
при |
200 |
°С |
практически |
||||||||||
необ ратим о, |
а при 300 |
°С |
циклогексан почти полностью |
дегидрируется в |
||||||||||
б ензол. |
П оэтом у |
гидрирование б ензола осуществляют при |
б олее низких |
|||||||||||
тем пературах(100— 200 °С ) наNi-катализаторе, адегидрирование— |
при б олее |
|||||||||||||
высокой тем пературе (350— 400 °С ) на другом катализаторе — |
С r2О 3, |
т.е. в |
||||||||||||
условиях, когда |
м ож но |
об еспечить |
полное превращение в ж елательном |
|||||||||||
направлении. |
|
|
|
|
|
|
|
|
|
|
|
|
||
Н аряду с классической терм одинам икой, к об ъяснению явлений катализа |
||||||||||||||
прим еняли |
такж е терм одинам ику необ ратим ых процессов. |
П риведем |
здесь |
|||||||||||
лиш ь |
конечный |
результат. |
П ринцип |
м икроскопической |
об ратим ости |
в |
||||||||
прим енении |
к кинетике и |
катализу |
приводит |
к |
принципу |
детального |
||||||||
равновесия, |
согласно котором у частота люб ого |
прям ого |
м олекулярного |
|||||||||||
процесса долж на ком пенсироваться |
частотой соответствующего |
об ратного |
||||||||||||
процесса. О тсюда следует, что в последовательной реакции А Ђ |
В |
Ђ |
С |
|||||||||||
частоты переходов А → В и В → А, |
а такж е В → С и С → В долж ны б ыть |
|||||||||||||
одинаковы |
и равновесие в сум м арной |
реакции |
А ↔ С |
не м ож ет |
б ыть |
|||||||||
осуществлено, наприм ер, циклическим |
способ ом |
|
|
|
|
|
|
|
||||||
П оэтом у природа пром еж уточныхвеществвпрям ой и об ратной реакциях долж на б ыть одинаковой. Конф игурация активных центров катализатора, а
9
такж е ком плексов активных центров с реагентам и для прям ой и об ратной реакций такж едолж наб ыть одинаковой.
К Л АС С И ФИ К АЦИ Я К АТАЛ И ТИ ЧЕ С |
К И Х П Р О ЦЕ С С О ВИ |
||||
К АТАЛ И ЗАТО Р О ВП О |
М Е ХАН И ЗМ У И П О |
Д Б О Р К АТАЛ И ЗАТО Р О В |
|||
М еханизм действия |
разных твердых катализаторов различен. |
Е диной |
|||
теории |
подб ора катализаторов (предвидения |
каталитического |
действия |
||
веществ) |
пока не существует. Как в катализе, |
так и в некаталитической |
|||
кинетике в б ольш инстве случаев не удается предвычислить каталитическую активность из-за незнания констант элем ентарных стадий. И там , и здесь для практических целей пользуются различным и корреляциям и каталитической активности или реакционной способ ности с хим ическим и или ф изическим и
свойствам и вещества. В катализе наиб олее плодотворны |
представления, |
учитывающие хим ическое соответствие катализатора и |
катализируем ой |
реакции. |
|
П олож ениеэлем ентавП ериодической систем е, т.е. строениеэлектронных
об олочек атом ов и |
ионов, |
в конечном |
счете определяет |
все основные |
|||
хим ические и |
ряд ф изических свойств вещества. |
П оэтом у |
сопоставление |
||||
каталитической |
активности |
твердых тел с полож ением |
в П ериодической |
||||
систем е элем ентов, |
их |
об разующих, |
привело |
к |
выявлению ряда |
||
законом ерностей подб оракатализаторов.
Д ля об щей ориентации в подб оре катализаторов полезна классиф икация каталитических процессов по м еханизм у действия катализаторов. С огласно Рогинском у, каталитическиереакции м ож но разделить надваб ольш их класса:
окислительно-восстановительные |
(одноэлектронные) и |
кислотно-основные |
|
(ионные). |
|
|
|
К первом у классу относят процессы, связанные с переходом |
электронов: |
||
окисление, восстановление, гидрирование, дегидрирование, |
разлож ение |
||
кислородсодерж ащих соединений |
типа Н 2О 2, N2O, |
KClO4. |
Т ипичным и |
катализаторам и для них являются м еталлы и полупроводники, т.е. вещества, об ладающиеподвиж ным и и легко возб уж даем ым и электронам и (или дыркам и). Н аиб олее ш ироко распространенным и катализаторам и этого класса являются переходные м еталлы, особ енно VIII B группы (Pt, Pd, Rh, Ru, Fe, Co, Ni), и м еталлы I B группы (Cu, Ag, Au); соединения переходных м еталлов: простые оксиды (V2O5, MnO2, Cr2O3, MoO3, Nb2O5), см еш анныеоксиды, ш пинели (Fe3O4, CuCr2O4, ZnCrO4), перовскиты (С аТ iO3, NaNbO3, NiLaO3 и др.), сульф иды
(MoS2, WS2, NiS, Co9S8), а такж е некоторые полупроводники, не им еющие в своем составепереходныхэлем ентов(ZnO, ZnS).
Ко втором у классу причисляют реакции кислотно-основного взаим одействия: каталитический крекинг, гидратация, дегидратация, гидролиз, м ногие реакции изом еризации, полим еризации, конденсации органических веществ. Т ипичным и катализаторам и этого класса являются твердые тела, об ладающие кислотным и (ам орф ные и синтетические алюм осиликаты, Аl2О 3, Т iO2, сверхкислоты: высококрем нистые цеолиты, гетерополикислоты) и основным и (MgO, CaO) свойствам и. Ч аще всего это ионные кристаллыдиэлектрики или ам орф ныенепроводящиетвердыевещества.
10
В отдельный, третий, классследует выделить катализ координационным и соединениям и. Координационная связь — это донорно-акцепторная связь, реализующаяся вком плексных соединениях. Э нергия координационной связи,
как правило, ниж е, |
чем |
энергия ковалентной связи. Э то об стоятельство |
|
об легчает об разование и |
участие координационно |
связанных соединений в |
|
каталитическихреакциях. |
|
|
|
Д ействительные |
законом ерности подб ора |
катализаторов зачастую |
|
являются б олее слож ным и. О дна и та ж е реакция в разных условиях и на разныхкатализаторахм ож ет протекать по окислительно-восстановительном у и по кислотно-основном у м еханизм ам .
|
|
|
АД С О |
Р Б ЦИ Я |
О |
сн о вн ы е |
стадии |
к атализа. |
Г етерогенно-каталитическую реакцию |
м ож но |
разб ить |
на следующие основные стадии: диф ф узия ком понентов к |
||
катализатору; адсорб ция; |
соб ственно |
каталитическая реакция (хим ические |
||
превращения наповерхности, об ычно несколько стадий); десорб ция и об ратная
диф ф узия продуктовреакции. |
|
|
|
|||
Больш ое |
количество |
катализаторов |
представляет соб ой |
гранулы, |
||
состоящие из порош ков, или пористые тела. |
В этом случае важ но доставить |
|||||
реагенты |
к |
поверхности. |
Различают кин ет ическую |
област ь |
протекания |
|
катализа, |
в |
которой скорость реакции определяется непосредственно |
||||
хим ическим и |
превращениям и на поверхности; област ь |
вн ешн ей |
диффузии, |
|||
когдареакцию лим итирует подвод реагентовиз газаили ж идкости кнаруж ной
поверхности или отвод их от наруж ной поверхности катализаторов; |
област ь |
вн ут рен н ей диффузии, когда лим итирующей стадией является |
перенос |
веществавпорахвнутри зернакатализатора. |
|
Адсо рб ц ия. Адсорбцией называют повыш ение концентрации |
м олекул, |
атом овили ионоввб лизи поверхности твердого тела. Адсорб ируем оевещество называют адсорбат ом , а твердое тело, на котором протекает адсорб ция, — адсорбен т ом . Адсорб ция реагирующих веществ и соответственно десорб ция
являются |
необ ходим ым и |
|
стадиям и |
в подавляющем |
б ольш инстве |
|||||
каталитических процессов. |
В |
таких процессах, |
по крайней |
м ере, один из |
||||||
реагентовдолж ен б ыть связан споверхностью, |
|
|
|
|||||||
т.е. адсорб ирован. |
|
|
|
|
|
|
|
|||
Различают |
ф изическую |
и |
хим ическую |
|
|
|
||||
адсорб цию. П ри физической |
адсорбцииатом ы |
|
|
|
||||||
или |
м олекулы |
адсорб ата |
сохраняют |
свою |
|
|
|
|||
индивидуальность, а силы, |
ответственные за |
|
|
|
||||||
адсорб цию, |
аналогичны ван-дер-ваальсовым |
|
|
|
||||||
силам |
в реальных газах. |
П ри |
хим ической |
|
|
|
||||
адсорбции адсорб ируем ая м олекула об разует |
|
|
|
|||||||
хим ическое |
соединение с |
|
твердым |
телом , |
|
|
|
|||
об ычно с атом ам и поверхности. П ри этом |
|
|
|
|||||||
|
|
|
||||||||
возникают |
ковалентная, |
|
ионная |
или |
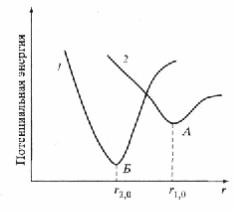
Рис. 2. П отенциальные |
|
||||
координационная связи. Н арис. 2 изоб раж ены |
кривые для ф изической |
|
||||||||
две потенциальные кривые, соответствующие |
адсорб ции (1) и хем осорб ции |
|
||||||||
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
