- •11.Закон сохранения момента импульса
- •12.Механические колебания
- •13.Идеальный газ
- •14.Распределение молекул идеального газа по скоростям хаотического теплового движения.
- •15.Распределение молекул в потенциальном поле сил
- •16.Первое начало термодинамики
- •Первое начало термодинамики
- •Работа газа при изменении его объема
- •17.Теплоемкость
- •18.Применение первого начала термодинамики к изопроцессам
- •19.Адиабатический процесс
- •20. II начало термодинамики
13.Идеальный газ
Понятие идеального газа. Уравнение состояния идеального газа. Основное уравнение молекулярно-кинетической теории идеального газа (вывод). Средняя квадратичная скорость движения молекул газа.
Идеальный газ – это такой газ, взаимодействием между молекулами которого можно пренебречь.
Соотношение, определяющее связь между параметрами состояния какого-либо тела, называется уравнением состояния идеального газа.
|
F(p,V,T)=0
|
Основное уравнение молекулярно-кинетической теории идеального газа (вывод)
Средняя квадратичной скоростью поступательного движения молекул газа называется корень квадратный из среднего арифметического значения квадратов скоростей поступательного движения всех его молекул:
|
Vкв.=√1/N ∑Ni=1 Ui2
|
14.Распределение молекул идеального газа по скоростям хаотического теплового движения.
Функция распределения Максвелла и ее физический смысл. График функции распределения молекул по скоростям движения. Наиболее вероятная, средняя арифметическая, среднеквадратичная скорость.
Закон Максвелла описывается некоторой функцией f(v), называемой функцией распределения молекул по скоростям. Если разбить диапазон скоростей молекул на малые интервалы, равные dv, то на каждый интервал скорости будет приходиться некоторое число молекул dN(v), имеющих скорость, заключенную в этом интервале. Функция f(v) определяет относительное число молекул dN(v)/N, скорости которых лежат в интервале от v до v+dv, т. е. dN(v)/N=¦(v)dv, откуда
|
¦(v)= |
(2.32) |
Применяя методы теории вероятностей, Максвелл нашел функцию f(v)– закон о распределении молекул идеального газа по скоростям:
|
¦(v)
= 4p
|
(2.33) |
Из (2.33) видно, что конкретный вид функции зависит от рода газа (от массы молекулы) и от параметра состояния (от температуры T).
График функции (2.33) приведен на рисунке 2.6.
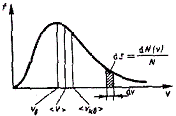
Рисунок 2.6
Так как при возрастании v множитель exp[-m0v2/(2kT)] уменьшается быстрее, чем растет множитель v2, то функция ¦(v) начинаясь от нуля, достигает максимума при vВ, и затем асимптотически стремится к нулю. Кривая несимметрична относительно vВ.
Относительное число молекул dN(v)/N, скорости которых лежат в интервале от v до v+dv, находится как площадь заштрихованной полоски на рисунке 2.6. Площадь, ограниченная кривой распределения и осью абсцисс, равна единице. Это означает, что функция ¦(v) удовлетворяет условию нормировки
|
|
(2.34) |
Скорость, при которой функция распределения молекул идеального газа по скоростям максимальна, называется наиболее вероятной скоростью. Значение наиболее вероятной скорости можно найти, продифференцировав выражение (2.33) (постоянные множители опускаем) по аргументу v, приравняв результат нулю и используя условие для максимума выражения ¦(v):
|
|
(2.35) |
Значения v = 0 и v = ¥ соответствуют минимумам выражения (2.33), а значение v, при котором выражение в скобках становится равным нулю, и есть искомая наиболее вероятная скорость vВ:
|
vВ
=
|
(2.36) |
Из формулы (2.36) следует, что при повышении температуры максимум функции распределения молекул по скоростям (рисунок 2.7) сместится вправо (значение наиболее вероятной скорости становится больше). Однако площадь, ограниченная кривой, остается неизменной, поэтому при повышении температуры кривая распределения молекул по скоростям будет растягиваться и понижаться.
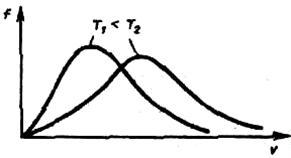
Рисунок 2.7
Средняя арифметическая скорость молекулы <v> определяется по формуле
|
|
(2.37) |
Подставляя сюда f(v) и интегрируя, получаем
|
|
(2.38) |
Скорости, характеризующие состояние газа:
1)
наиболее вероятная
![]() ;
;
2)
средняя
![]() ;
;
3)
средняя квадратичная
![]() .
.
Исходя из распределения молекул по скоростям
|
|
(2.39) |
можно
найти распределение молекул газа по
значениям кинетической энергии
![]() .
Для этого перейдем от переменнойv
к переменной
.
Для этого перейдем от переменнойv
к переменной
![]() .
Подставив в (2.39)
.
Подставив в (2.39)![]() и
и![]() получим
получим
|
|
(2.40) |
где dN (e) – число молекул, имеющих кинетическую энергию поступательного движения, заключенную в интервале от e до e+de.
Таким образом, функция распределения молекул по энергиям теплового движения
|
|
(2.41) |
Средняя кинетическая энергия <e > молекулы идеального газа
|
|

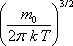 v2exp[-m0v2/(2kT)]
.
v2exp[-m0v2/(2kT)]
.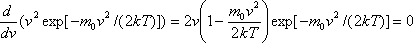
 .(
.(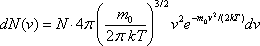 ,
,