
- •1) Предмет и задачи химической науки
- •2) Значение химии для медиков
- •3) Роль н2о и растворов в жизнедеятельности.
- •1. Влияние равновесия с образованием комплексного соединения на гетерогенное равновесие.
- •2. Влияние кислотно-основного равновесия на гетерогенное равновесие.
- •3. Влияние окислительно-восстановительного равновесия на ге-
- •8). Сильные и слабые электролиты.
- •9). Степень и константа диссоциации. Факторы, влияющие на степень и константу диссоциации.
- •10). Сформулируйте закон разведения Оствальда.
- •11). Что называют ионной силой раствора? Закон Дебая-Хюккеля.
- •12). Роль электролитов в процессах жизнедеятельности.
- •13). Процессы сольватации и гидратации. Сольволиз и гидролиз.
- •14). Гидролиз солей. Дайте определение гидролизу. Гидролиз с точки зрения протолитической теории.
- •15. Какие типы солей подвергаются гидролизу? Типы гидролиза.
- •16.Роль гидролиза биоорганических соединений в процессах жизидеятельности?
- •17.Напишите уравнение гидролиза атф. Какова роль этого процесса в организме человека?
- •18.Как выражается константа гидролиза для различных случаев гидролиза? Что называется константой гидролиза? От чего зависит константа гидролиза соли?
- •19.Как определяется степень гидролиза, факторы влияющие на степень гидролиза.
- •20. Что называют растворами? Значение растворов в жизнедеятельности организмов?
- •21.Классификация растворов: растворы электролитов, неэлектролитов, растворы амфолитов, растворы полиэлетролитов.
- •22.Концентрация растворов и способы её выражения
- •23.Диффузия в растворах. Закон Фика. Уравнение Эйнштейна-Смолуховского
- •24. Факторы, влияющие на скорость диффузии. Роль диффузии в процессах переноса веществ в биологических системах
- •25.Коллигативные свойства разбавленных растворов электролитов
- •26. Закон Рауля и следствия из него: понижение температуры замерзания растворителя, повышение температуры кипения, осмос.
- •27. Осмос. Осмотическое давление. Закон Вант-Гоффа. Зависит ли осмотическое давление от природы растворённого вещества?
- •50)Предмет химической кинетики?
- •51) Что понимают под скоростью химической реакции?
- •52)В чем различие гомогенных и гетерогенных химических процессов?
- •53)Как выражается средняя и истинная скорость химических реакций?
- •54)Какие факторы влияют на скорость химической реакции?
- •55) Закон действия масс?
- •56)Что такое константа скорости химической реакции?
- •58.Порядок и молекулярность реакции.
- •59.Какое явление называется катализом? Отличие гомогенного от гетерогенного. Особенности ферментативного катализа.
- •61.Выражение константы равновесия через равновесные концентрации реагирующих веществ.Каков физический смысл константы равновесия.
- •62.Принцип Ле Шателье.
- •63.При увеличении температуры увеличиваются скорости как прямой,так и обратной реакции.Почему наблюдается смещение равновесия?Изменяется ли при этом константа хим.Равновесия?
- •71 Теория мономолекулярной адсорбции Ленгмюра.
- •72. Уравнение Фрейндлиха.
- •73. Правило Шилова .
- •75.Классификация дисперсных систем по размеру частиц дф и степени дисперстности .
- •77. Классификация дисперсных систем по агрегатному состоянию фаз , их виды и обозначения .?
- •86Понятие от полимерах. Природные биополимеры
- •89Классификация вмс
- •II. По природе высокомолекулярные соединения подразделяются на:
- •90.Способы получения вмс
- •99) Взаимосвязь между процессами обмена веществ и энергии. Калорийность основных составных частей пищи и некоторых продуктов. Расход энергии при различных видах двигательной активности.
- •101. Термодинамически обратимые и необратимые процессы. Второй и третий закон термодинамики.
- •102. Энтропия. Статистическое и термодинамическое толкование энтропии. Стандартная энтропия.
- •103. Свободная энергия Гиббса(изобарно-изотермический потенциал). Энтальпийный и энтропийный факторы. Экзо- и эдноэрганические процессыв организме
- •104)Термодинамические и кинетические аспекты химического равновесия
- •105) Кислотно-основное равновесие. Современные представления о кислотно-основных равновесиях.
- •10. Структурная и пространственная изомерии.
- •20. Что такое Ка,рКа? Какая существует зависимость между их величиной и силой кислоты?
- •21. Дать определения кислоты и основания по теории Бренстеда.
- •22. От каких факторов зависит сила кислот? Перечислите их.
- •23. Как зависит кислотность от природы атома в кислотном центре? Как она изменяется в группах, периодах? Почему?
- •24. Охарактеризуйте влияние донорных и акцепторных заместителей на силу кислоты и оснований.
- •37. Гетерофункциональный заместитель как фактор, влияющий на химические свойства реакционного центра. Специфические реакции гетерофункциональных соединений.
10. Структурная и пространственная изомерии.
Пространственная
изомерия -
это существование изомеров, имеющих
одинаковый состав и порядок соединения
атомов, но отличающихся характером
расположения атомов или групп атомов
в пространстве относительно друг
друга.Бывает :
Геометрической – она
характерна для соединений ,
содержащих двойную связь или замкнутый
цикл. Например, цис и транс
изомеры.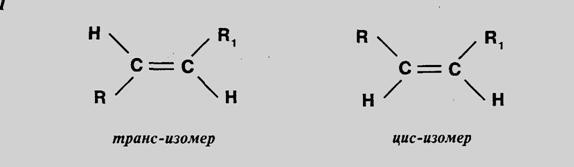 Оптической
– в которой изомеры имеют одинаковые
физические и химические свойства, но
имеют зеркальное отображение.
Оптической
– в которой изомеры имеют одинаковые
физические и химические свойства, но
имеют зеркальное отображение.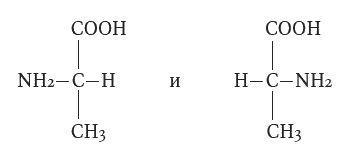 Структурные
изомеры – это изомеры, имеющие одинаковый
качественный и количественный состав,
но отличающиеся химическим строением.
Различают:
Межклассовую
изомерию
Структурные
изомеры – это изомеры, имеющие одинаковый
качественный и количественный состав,
но отличающиеся химическим строением.
Различают:
Межклассовую
изомерию

Изомерию
углеродного скелета
 Изомерия
положения – тоже делится на:
изомерию
положения кратной связи
Изомерия
положения – тоже делится на:
изомерию
положения кратной связи![]() Функциональной
группы
Функциональной
группы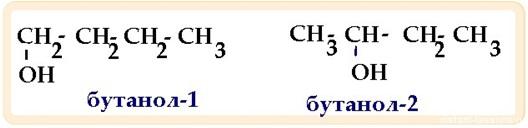 и радикалов-заместителей
и радикалов-заместителей 11.
Конфигурация и конформация
Пространственные
изомеры делятся на два вида: конформационные
и конфигурационные.
11.
Конфигурация и конформация
Пространственные
изомеры делятся на два вида: конформационные
и конфигурационные.
Конфигурации – это порядок расположения атомов в пространстве без учета различий, которые возникают в результате вращения вокруг одинарных связей . Эти изомеры существуют в виде различных конформаций.
Конформации – очень неустойчивые динамические формы одной и той же молекулы, которые возникают в резцльтате вращения атомов или групп атомов вокруг одинарных связей, в результате чего атомы занимают различное пространственное положение. Каждая конформация молекулы характеризуется определённой конфигурацией. Различают: заслоненную и заторможенную конформации. Заслонённая конформация возникает в том случае, если одинаковые заместители расположены на минимальном расстоянии друг от друга и между ними возникают силы взаимного отталкивания, и молекула должна обладать большим запасом энергии, чтобы сохранить эту конформацию. Эта конформация энергетически невыгодна. Заторможенная конформация – возникает в том случае, если одинаковые заместители максимально удалены друг от друга и молекула обладает минимальным запасом энергии. Эта конформация энергетически выгодна.
12) ПОНЯТИЕ АРОМОТИЧНОСТИ.СОПРЯЖЕНИЕ И ЭЛЕКТРОННЫЕ ЭФФЕКТЫ Ароматичность — особое свойство некоторых химических соединений, благодаря которому сопряженное кольцо ненасыщенных связей проявляет аномально высокую стабильность; большую чем та, которую можно было характеризующим совокупность структурных и энергетических свойств некоторых циклических молекул, содержащих систему сопряженныхдвойных связей. ЭЛЕКТРОННЫЕ ЭФФЕКТЫЗамещение атомов водорода в молекулах алканов на любой гетероатом (галоген, азот, серу, кислород и т.д) или группу вызывает перераспределение электронной плотности. Природа этого явления различна. Она зависит от свойств гетероатома (его электроотрицательности) и от типа связей, по которым это влияние распространяется.Если влияние заместителя передается при участии s-связей, то происходит постепенное изменение электронного состояния связей. Такая поляризация называется индуктивным эффектом (I), изображается стрелкой в направлении смещения электронной плотности. Индуктивный эффект обусловлен стремлением атома или группы атомов подавать или оттягивать на себя электронную плотность, в связи с чем он может быть положительным или отрицательным. Отрицательный индуктивный эффект проявляют элементы, более электроотрицательные, чем углерод, т.е. галогены, кислород, азот и другие, а также группы с положительным зарядом на элементе, связанном с углеродом. Отрицательный индуктивный эффект уменьшается справа налево в периоде и сверху вниз в группе периодической системы:F > O > NF > Cl > Br > JВ случае заместителей с полным зарядом отрицательный индуктивный эффект увеличивается с возрастанием электроотрицательности атома, связанного с углеродом:>O+- > >N+<В случае сложных заместителей отрицательный индуктивный эффект определяется природой атомов, составляющих заместитель. Кроме этого индуктивный эффект зависит от характера гибридизации атомов. Так, электроотрицательность атомов углерода зависит от гибридизации электронных орбиталей:sp3 < sp2 < spПоложительный индуктивный эффект проявляют: элементы, менее электроотрицательные, чем углерод, группы с полным отрицательным зарядом, алкильные группы. +I – эффект уменьшается в ряду:(СН3)3С- > (CH3)2CH- > CH3-CH2- > CH3- > H- Сопряжение связей один из важнейших видов внутримолекулярного взаимноговлияния атомов и связей в органических соединениях; обусловлено взаимодействием электронных систематомов (прежде всего валентных электронов 13)СТЕРЕОИЗОМЕРЫ. Оптическая изомерия молекул. ЭЛЕМЕНТЫ СИММЕТРИИ МОЛЕКУЛ Стереоизомеры (пространственные изомеры) — химические соединения, имеющие одинаковое строение, но отличающиеся пространственным расположением атомов. Стереоизомеры имеют одинаковую конституцию, но различные конфигурацию и/или конформацию. Многие органические соединения представляют собой смесь двух так называемых оптических изомеров - веществ, имеющих совершенно одинаковые химические свойства, но различающихся так называемой оптической активностью. Они по-разному отклоняют луч поляризованного света, проходящий через их кристаллы или растворы, и в соответствии с направлением этого отклонения называются право- или левовращающими; свойством этим обладают лишь чистые изомеры, смеси же их оптически неактивны. Явление это связывают с наличием в молекуле таких веществ так называемого асимметричного атома углерода, к четырем валентностям которого могут в разном порядке присоединяться четыре соответствующих радикала симметрия СИММЕТРИЯ МОЛЕКУЛ хар-ка молекулы, определяемая совокупностью возможных операций точечной симметрии для еёравновесной конфигурации.
|
14) АССИМЕТРИЧЕСКИЙ АТОМ УГЛЕРОДА Атом углерода, связанный с четырьмя различными группами, называется асимметрическим атомом углерода.Многие, но не все, молекулы, содержащие асимметрический атом углерода, диссимметричны. Многие, но не все, диссимметричные молекулы содержат асимметрический атом углерода. Существуют молекулы, в которых имеются асимметрические атомы углерода и которые все же не являются диссим-метричными ). В то же время существуют диссимметричные молекулы, не содержащие асимметрического атома углерода .Таким образом, наличие или отсутствие асимметрического атома углерода не является критерием диссимметрки. |
|
| ||||
|
|
|
|
|
| ||
|
15) ОПТИЧЕСКАЯ АКТИВНОСТЬ.ЭНАНТИОМЕРЫ.ДИАСТЕРЕОМЕРИЯ. .ОПТИЧЕСКАЯ АКТИВНОСТЬ, способность в-ва- твердого, жидкого или газа-вращать плоскость поляризациипроходящего через него света. Такие в-ва наз. оптически активными. Поворот происходит либо вправо (по часовой стрелке), либо влево (против часовой стрелки), если смотреть навстречу ходу лучей света. Оптической активностью обладают энантиомеры Энантиомеры — пара стереоизомеров, представляющих собой зеркальные отражения друг друга, не совмещаемые в пространстве. ДИАСТЕРЕОМЕРИЯДИАСТЕРЕОМЕРИЯ - вид пространственной изомерии химических соединений, не являющихся оптическими изомерами |
|
|
|
| ||
|
16) РАЦЕМАТЫ. РАСЩЕПЛЕНИЕ РАЦЕМАТОВ. РАЦЕМАТЫ, состоят из эквимол. кол-в энантиомеров и не обладают оптич. активностью" Существуют в виде мол. соединений (истинные рацематы) и рацемич. смесей кристаллич. энантиомеров (конгломерата, т. е. простой смесикристаллов право- и левовращающего антиподов) или смешанных кристаллов, образованных обоимиэнантиомерами. Рацемизация. Рацематы образуются также в результате рацемизации оптически активных соед., представляющей собой обратимое взаимное превращение энантиомеров. В отсутствие асимметризующих факторов этот процесс заканчивается установлением динамич. равновесия между ними при строго эквимолярном содержанииэнантиомеров в смеси. Обратный рацемизации процесс - выделение энантиомеров из их рацемич. смеси-наз.расщеплением рацематов. Впервые расщепление рацематов было осуществлено (Л. Пастер, 1848) прикристаллизации натрий-аммониевой соли виноградной к-ты; выделенный осадок представлял собой энан-тиоморфную смесь кристаллов, а индивидуальные кристаллы-либо лево-, либо правовращающие формы винной к-ты. Известно лишь неск. десятков примеров расщепления рацематов при спонтанной кристаллизацииэнантиомеров. Более общий метод заключается в том, что в пересыщ. р-р рацематов вводят затравку кристалловодного из энантиомеров, что приводит к кристаллизации именно этого оптич. изомера. Затем в оставшийся р-р добавляют затравку кристаллов второго энантиомера и тем самым вызывают его кристаллизацию, поскольку именно этим оптич. изомером пересыщен оставшийся р-р, и т.д. Расщепление рацематов путем затравочнойкристаллизации реализовано в пром-сти (напр., для D,L-глутаминовой к-ты), однако этот способ также не универсален.Др. способ расщепления рацематов-биохимический-основан на том, что микроорганизмы при своем развитии используют только один из двух оптич. изомеров, присутствующих в рацематах. Остающийся энантиомер м. б. выделен. Этот путь позволяет получать только один из энантиомеров, второй необратимо теряется. Избирательность действия микроорганизмов по отношению к энантиомерам связана с высокой энантиоселективностью содержащихся в микроорганизмах ферментов. Поэтому для разделения энантиомеров нет необходимости применять сами микроорганизмы, достаточно использовать в этих целях выделенные из биол. объектов ферментные препараты. Наиб. широко для расщепления рацематов применяют гидролазы - ферменты, катализирующие гидролиз сложноэфирных или амидных связей. При этом гидролизу подвергается только один из двух энантиомеров субстрата, а разделение конечной смеси, напр., своб. к-ты и ее сложного эфира м. б. легко осуществлено обычными методами. Так, при действии фермента ацилазы на рацемич. N-ациламинокислотугидролизу (а следовательно, и отделению) подвергается лишь L-форма. |
|
|
|
| ||
|
17) Связь пространственного строения соединений с ихбиологической активностью. В организме реакции протекают с участием биокатализаторов — ферментов. Ферменты построены изхиральных молекул а-аминокислот. Поэтому они могут играть роль хиральных реагентов, чувствительных к хиральности взаимодействующих с ними субстратов. Таким образом,пространственное строение молекул связано со стереоспецнфичностью биохимических процессов. Стереоспецифичность процессов, протекающих в организме, состоит в том, что в реакцию вовлекаются определенные стереоизомеры и результатом реакции являются такжестереохимически определенные продукты. |
|
|
18) КАК ДЕЛЯТСЯ КИСЛОТЫ В ЗАВИСИМОСТИ ОТ ПРИРОДЫ ЭЛЕМЕНТВ, СВЯЗАННОЙ С ПРОТОНОМ? В зависимости от природы элемента, с которым связан протон, кислоты делятся на ОН-кислоты (карбоновые кислоты, фенолы, спирты), SH-кислоты (тиолы), NH-кислоты (амины, амиды, имиды), СН-кислоты (углеводороды и их производные). Элемент и связанный с ним атом водорода называют кислотным центром 19. Сравните кислотность этиленгликоля и этанола. Кислотность этиленгликоля выше, чем у этанола. Благодаря более выраженным кислотным свойствам многоатомные спирты реагируют с Сu(OH)2, образуя растворимые комплексные соединения – хелаты.
![]()
