
белки к зачёту
.doc1 Коллок. Ферменты. Белки.
№1.Общая характеристика белков.
Белки, или протеины, — сложные высокомолекулярные органические соединения (сложные полипептиды), построенные из остатков аминокислот, соединенных между собой амидными связями. В состав одного и того же белка входят различные аминокислоты. При полном гидролизе белок превращается в смесь аминокислот.
Молекулярная масса белков весьма велика: так, молекулярная масса альбумина сыворотки крови человека 61 500, у-глобулина сыворотки крови 153 000, гемоцианина улитки б 600 000.
История изучения белков.
Белки были выделены в отдельный класс биологических молекул в XVIII веке в результате работ французского химика Антуана Фуркруа и других учёных, в которых было отмечено свойство белков коагулировать (денатурировать) под воздействием нагревания или кислот.
Голландский химик Геррит Мульдер провёл анализ состава белков и выдвинул гипотезу, что практически все белки имеют сходную эмпирическую формулу.
В начале XX века немецкий химик Эмиль Фишер экспериментально доказал, что белки состоят из аминокислотных остатков, соединённых пептидными связями. Он же осуществил первый анализ аминокислотной последовательности белка и объяснил явление протеолиза.
В XXI веке исследование белков перешло на качественно новый уровень, когда исследуются не только индивидуальные очищенные белки, но и одновременное изменение количества и посттрансляционных модификаций большого числа белков отдельных клеток, тканей или организмов. Эта область биохимии называется протеомикой. С помощью методов биоинформатики стало возможно не только обработать данные рентгенно-структурного анализа, но и предсказать структуру белка, основываясь на его аминокислотной последовательности. В настоящее время криоэлектронная микроскопия больших белковых комплексов и предсказание малых белков и доменов больших белков с помощью компьютерных программ по точности приближаются к разрешению структур на атомном уровне.
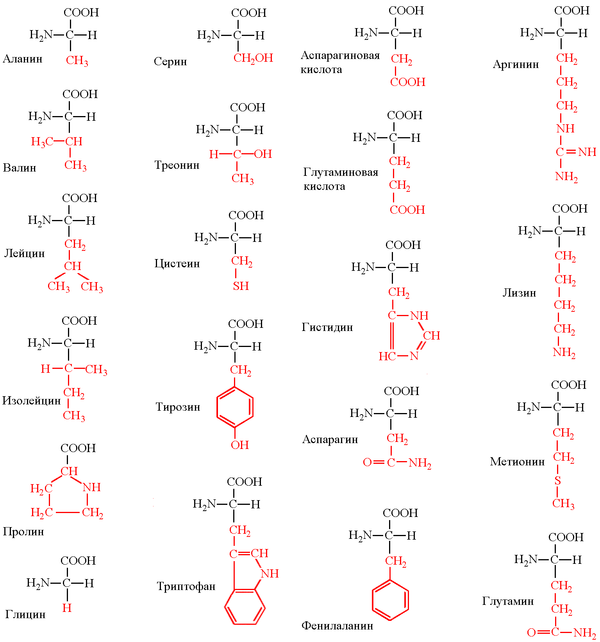
№2.Протеиногенные аминокислоты.
В процессе биосинтеза белка в полипептидную цепь включаются 20 α-аминокислот, кодируемых генетическим кодом. Помимо этих аминокислот, называемых протеиногенными, или стандартными, в некоторых белках присутствуют специфические нестандартные аминокислоты, возникающие из стандартных в процессе посттрансляционных модификаций. В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин (Sec, U) и пирролизин (Pyl, O). Это так называемые 21-я и 22-я аминокислоты.
Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся не решённым. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих. Например, ключевым промежуточным метаболитом пути биосинтеза треонина, изолейцина и метионина является α-аминокислота гомосерин. Очевидно, что гомосерин — очень древний метаболит, но для треонина, изолейцина и метионина существуют аминоацил-тРНК-синтетазы, тРНК, а для гомосерина — нет.
 ❤
❤
По функциональным группам
Алифатические
Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
Оксимоноаминокарбоновые: серин, треонин
Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
Амиды моноаминодикарбоновых: аспарагин, глутамин
Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
Серосодержащие: цистеин, метионин
Ароматические: фенилаланин, тирозин, триптофан, (гистидин)
Гетероциклические: триптофан, гистидин, пролин
Иминокислоты: пролин
По способности организма синтезировать из предшественников
Незаменимые
Для большинства животных и человека незаменимыми аминокислотами являются: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан, аргинин, гистидин.
Заменимые
Для большинства животных и человека заменимыми аминокислотами являются: глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
№3.Первичная структура белка.
К настоящему времени расшифрована первичная структура десятков тысяч разных белков, что является несомненным достижением биохимии. Однако это число ничтожно мало, если учесть, что в природе около 1012 разнообразных белков. Под первичной структурой подразумевают порядок, последовательность расположения аминокислотных остатков в полипептидной цепи. Зная первичную структуру, местоположение каждого остатка аминокислоты, можно точно написать структурную формулу белковой молекулы, если она представлена одной полипептидной цепью. Если в состав белка входит несколько полипептидных цепей, объединенных в одну белковую молекулу посредством дисульфидных связей и нековалент-ных взаимодействий, или если одна полипептидная цепь содержит внутренние дисульфидные связи, то задача определения первичной структуры несколько осложняется, так как необходимо предварительное разъединение этих цепей и связей.
Разъединение таких полипептидных цепей производят с помощью денатурирующих агентов (растворы 8М мочевины или 6М гуанидингидрохлорида), разрывающих нековалентные связи. Дисульфид-ные связи разрушают путем окисления или восстановления (надмуравьиной кислотой или β-меркаптоэтанолом соответственно), при этом образуются свободные полипептиды, содержащие или остатки цистеиновой кислоты, или цистеина:
Для определения первичной структуры отдельной, химически гомогенной полипептидной цепи в первую очередь методами гидролиза выясняют аминокислотный состав, точнее, соотношение каждой из 20 аминокислот в образце гомогенного полипептида. Затем приступают к определению химической природы концевых аминокислот полипептидной цепи, содержащей одну свободную NH2-группу и одну свободную СООН-группу.
№4.Конформация белков.
Функциональные свойства белков определяются их конформацией, т.е. расположением полипептидной цепи в пространстве. Уникальность конформации для каждого белка определяется его первичной структурой. В белках различают два уровня конформации пептидной цепи - вторичную и третичную структуру. Вторичная структура белков обусловлена способностью групп пептидной связи к водородным взаимодействиям: C=O....HN.
По обеим сторонам жесткой пептидной связи возможно вращение: y и j -углы, характеризующие вращение относительно одинарных связей С a -C и C a -N.
Пептид стремится принять конформацию с максимумом водородных связей. Однако возможность их образования ограничивается тем, что пептидная связь имеет частично двойной характер, поэтому вращение вокруг нее затруднено. Пептидная цепь приобретает не произвольную, а строго определенную конформацию, фиксируемую водородными связями.
Известны несколько способов укладки полипептидной цепи: a -спираль - образуется внутрицепочечными водородными связями между NH-группой одного остатка аминокислоты и CO-группой четвертого от нее остатка; b -структура (складчатый лист) - образуется межцепочечными водородными связями или связями между участками одной полипептидной цепи изогнутой в обратном направлении; беспорядочный клубок - это участки, не имеющие правильной, периодической пространственной организации. Но конформация этих участков также строго обусловлена аминокислотной последовательностью. Содержание a -спиралей и b -структур в разных белках различно: у фибриллярных белков - только a -спираль или только b -складчатый лист; а у глобулярных белков - отдельные фрагменты полипептидной цепи: либо a -спираль, либо b -складчатый лист, либо беспорядочный клубок.
Конформация полипептидных цепей: а - a -спираль, б - b -складчатый лист.
В одном и том же белке могут присутствовать все три способа укладки полипептидной цепи:
Третичная структура глобулярных белков представляет ориентацию в пространстве полипептидной цепи, содержащей a -спирали, b -структуры и участки без периодической структуры (беспорядочный клубок). Дополнительное складывание скрученной полипептидной цепи образует компактную структуру. Это происходит, прежде всего, в результате взаимодействия между боковыми цепями аминокислотных остатков. Существует несколько видов взаимодействия между R-группами, в основном нековалентного характера:
Связи, стабилизирующие третичную структуру:
электростатические силы притяжения между R-группами, несущими противоположно заряженные ионогенные группы (ионные связи);
водородные связи между полярными (гидрофильными) R-группами;
гидрофобные взаимодействия между неполярными (гидрофобными) R-группами;
дисульфидные связи между радикалами двух молекул цистеина. Эти связи ковалентные. Они повышают стабильность третичной структуры, но не всегда являются обязательными для правильного скручивания молекулы. В ряде белков они могут вообще отсутствовать.
Пространственная структура миоглобина.
В полипептидной цепи показаны только a -углеродные атомы. Красным показан гем (небелковый компонент).
Доменные белки содержат обособленные глобулы - домены, образованные одной и той же пептидной цепью. Домены соединены пептидными перемычками. Вторичная и третичная укладка полипептидной цепи белка полностью определяется его первичной структурой.
№5.Четвертичная структура белка.
Под четвертичной структурой подразумевают способ укладки в пространстве отдельных полипептидных цепей, обладающих одинаковой (или разной) первичной, вторичной или третичной структурой, и формирование единого в структурном и функциональном отношениях макромолекулярно-го образования. Многие функциональные белки состоят из нескольких полипептидных цепей, соединенных не главновалентными связями, а неко-валентными (аналогичными тем, которые обеспечивают стабильность третичной структуры). Каждая отдельно взятая полипептидная цепь, получившая название протомера, мономера или субъединицы, чаще всего не обладает биологической активностью. Эту способность белок приобретает при определенном способе пространственного объединения входящих в его состав протомеров, т.е. возникает новое качество, не свойственное мономерному белку. Образовавшуюся молекулу принято называть олигоме-ром (или мультимером). Олигомерные белки чаще построены из четного числа протомеров (от 2 до 4, реже от 6 до 8) с одинаковыми или разными молекулярными массами – от нескольких тысяч до сотен тысяч. В частности, молекула гемоглобина состоит из двух одинаковых α- и двух β-полипептидных цепей, т.е. представляет собой тетрамер.
В определенных условиях (присутствие солей, 8М мочевины или резкие изменения рН) молекула гемоглобина обратимо диссоциирует на две α-и две β-цепи. Эта диссоциация обусловлена разрывом водородных связей. После удаления солей или мочевины происходит автоматическая ассоциация исходной молекулы гемоглобина .
Классическим примером олигомерной молекулы, или надмолекулярной структуры, является вирус табачной мозаики, представляющий собой гигантскую молекулу с мол. м. около 40•106. Он состоит из одной молекулы РНК (см. главу 3) и 2130 белковых субъединиц, масса каждой из которых составляет 17500. Длина вируса примерно 300 нм, ширина – около 17 нм. РНК вируса имеет спиралеобразную форму. Вокруг РНК нанизаны белковые частицы, образующие гигантскую надмолекулярную спиральную структуру, в которой насчитывается около 130 витков Удивительной особенностью вируса является то, что после разъединения соответствующими приемами (добавление детергента) РНК и белковых субъединиц и последующего их смешивания (с предварительным удалением детергента) наблюдаются полная регенерация четвертичной структуры, восстановление всех физических параметров и биологических функций (инфектив-ная способность вируса). Подобная точность процесса спонтанной самосборки вируса обеспечивается, вероятнее всего, информацией, содержащейся в первичной структуре молекулы РНК и белковых субъединиц. Таким образом, последовательность аминокислот содержит в себе информацию, которая реализуется на всех уровнях структурной организации белков.
Многие ферменты также обладают четвертичной структурой, например фосфорилаза а, состоящая из двух идентичных субъединиц, в каждой из которых по две пептидные цепи. Вся молекула фосфорилазы а, таким образом, представляет собой тетрамер. Отдельные субъединицы чаще всего не обладают каталитической активностью; вообще регуляторные ферменты имеют четвертичную олигомерную структуру. Они наделены функцией обеспечения в клетке требуемых скоростей химических реакций.
Наиболее изученным олигомерным ферментом является лактатдегидро-геназа (она катализирует обратимое превращение пировиноградной кислоты в молочную), содержащая два типа полипептидных цепей: Н – сердечный тип (от англ. heart – сердце) и М – мышечный тип (от англ. muscle – мышца) – и состоящая из 4 субъединиц. Этот фермент благодаря различным сочетаниям субъединиц может существовать в 5 формах. Такие ферменты получили название изоферментов, или, в соответствии с новой классификацией, множественных форм ферментов .
К настоящему времени субъединичная структура обнаружена у нескольких сотен белков. Однако только для немногих белков, в том числе для молекулы гемоглобина, методом рентгеноструктурного анализа расшифрована четвертичная структура . Основными силами, стабилизирующими четвертичную структуру, являются нековалентные связи между контактными площадками протомеров, которые взаимодействуют друг с другом по типу комплементарности – универсальному принципу, свойственному живой природе. Структура белка после его синтеза в рибосоме может частично подвергаться модификации (посттрансляционный процессинг): например, при превращении предшественников ряда ферментов или гормонов (инсулин).
Некоторые исследователи склонны рассматривать, и не без основания, существование пятого уровня структурной организации белков. Речь идет о полифункциональных макромолекулярных комплексах, или ассоциатах из разных ферментов, получивших название метаболических олигомеров, или метаболонов, и катализирующих весь путь превращений субстрата (синте-тазы высших жирных кислот, пируватдегидрогеназный комплекс, дыхательная цепь).
№6.Биологические функции белков.
Белки выполняют множество самых разнообразных функций, характерных для живых организмов, с некоторыми из которых мы познакомимся более подробно при дальнейшем изучении курса. Ниже рассматриваются главные и в некотором смысле уникальные биологические функции белков, несвойственные или лишь частично присущие другим классам биополимеров.
Каталитическая функция. К 1995 г. было идентифицировано более 3400 ферментов. Большинство известных в настоящее время ферментов, называемых биологическими катализаторами, является белками. Эта функция белков, хотя и не оказалась уникальной, определяет скорость химических реакций в биологических системах.
Транспортная функция. Дыхательная функция крови, в частности перенос кислорода, осуществляется молекулами гемоглобина – белка эритроцитов. В транспорте липидов принимают участие альбумины сыворотки крови. Ряд других сывороточных белков образует комплексы с жирами, медью, железом, тироксином, витамином А и другими соединениями, обеспечивая их доставку в соответствующие органы-мишени.
Защитная функция. Основную функцию защиты в организме выполняет иммунная система, которая обеспечивает синтез специфических защитных белков-антител в ответ на поступление в организм бактерий, токсинов, вирусов или чужеродных белков. Высокая специфичность взаимодействия антител с антигенами (чужеродными веществами) по типу белок-белковое взаимодействие способствует узнаванию и нейтрализации биологического действия антигенов. Защитная функция белков проявляется и в способности ряда белков плазмы крови, в частности фибриногена, к свертыванию. В результате свертывания фибриногена образуется сгусток крови, предохраняющий от потери крови при ранениях.
Сократительная функция. В акте мышечного сокращения и расслабления участвует множество белковых веществ. Однако главную роль в этих жизненно важных процессах играют актин и миозин – специфические белки мышечной ткани. Сократительная функция присуща не только мышечным белкам, но и белкам цитоскелета, что обеспечивает тончайшие процессы жизнедеятельности клеток (расхождение хромосом в процессе митоза).
Структурная функция. Белки, выполняющие структурную (опорную) функцию, занимают по количеству первое место среди других белков тела человека. Среди них важнейшую роль играют фибриллярные белки, в частности коллаген в соединительной ткани, кератин в волосах, ногтях, коже, эластин в сосудистой стенке и др. Большое значение имеют комплексы белков с углеводами в формировании ряда секретов: мукоидов, муцина и т.д. В комплексе с липидами (в частности, с фосфолипидами) белки участвуют в образовании биомембран клеток.
Гормональная функция. Обмен веществ в организме регулируется разнообразными механизмами. В этой регуляции важное место занимают гормоны, синтезируемые не только в железах внутренней секреции, но и во многих других клетках организма (см. далее). Ряд гормонов представлен белками или полипептидами, например гормоны гипофиза, поджелудочной железы и др. Некоторые гормоны являются производными аминокислот.
Питательная (резервная) функция. Эту функцию выполняют так называемые резервные белки, являющиеся источниками питания для плода, например белки яйца (овальбумины). Основной белок молока (казеин) также выполняет главным образом питательную функцию. Ряд других белков используется в организме в качестве источника аминокислот, которые в свою очередь являются предшественниками биологически активных веществ, регулирующих процессы метаболизма.
Можно назвать еще некоторые другие жизненно важные функции белков. Это, в частности, экспрессия генетической информации, генерирование и передача нервных импульсов, способность поддерживать онкотическое давление в клетках и крови, буферные свойства, поддерживающие физиологическое значение рН внутренней среды, и др.
Таким образом, из этого далеко не полного перечня основных функций белков видно, что указанным биополимерам принадлежит исключительная и разносторонняя роль в живом организме. Если попытаться выделить главное, решающее свойство, которое обеспечивает многогранность биологических функций белков, то следовало бы назвать способность белков строго избирательно, специфически соединяться с широким кругом разнообразных веществ. В частности, эта высокая специфичность белков (сродство) обеспечивает взаимодействие ферментов с субстратами, антител с антигенами, транспортных белков крови с переносимыми молекулами других веществ и т.д. Это взаимодействие основано на принципе биоспецифического узнавания, завершающегося связыванием фермента с соответствующей молекулой субстрата, что содействует протеканию химической реакции. Высокой специфичностью действия наделены также белки, которые участвуют в таких процессах, как дифференцировка и деление клеток, развитие живых организмов, определяя их биологическую индивидуальность.
№7.Глобулярные и фибриллярные белки.
Глобулярные белки́ — белки, в молекулах которых полипептидные цепи плотно свёрнуты в компактные шарообразные структуры — глобулы (третичные структуры белка)
Глобулярная структура белков обусловлена гидрофобно-гидрофильными взаимодействиями.
К глобулярным белкам относятся ферменты, иммуноглобулины, некоторые гормоны белковой природы (например, инсулин) а также другие белки, выполняющие транспортные, регуляторные и вспомогательные функции.
Фибриллярные белки — белки, имеющие вытянутую нитевидную структуру, в которой отношение поперечной оси к продольной больше 1:10. Большинство фибриллярных белков не растворяется в воде, имеет большую молекулярную массу и высоко регулярную пространственную структуру, которая стабилизируется, главным образом, взаимодействиями (в том числе и ковалентными) между различными полипептидными цепями. Первичная и вторичная структура фибриллярного белка также, как правило, регулярна[1]. Полипептидные цепи многих фибриллярных белков расположены параллельно друг другу вдоль одной оси и образуют длинные волокна (фибриллы) или слои.
К фибриллярным белкам относят:
α-структурные фибриллярные белки (кератины, на долю которых приходится почти весь сухой вес волос и других роговых покровов, тропомиозин, белки промежуточных филаментов)
β-структурные фибриллярные белки (фиброин шёлка)
коллаген — белок сухожилий и хрящей.
№8.Физико-химические свойства белков.
Наиболее характерными физико-химическими свойствами белков являются высокая вязкость растворов, незначительная диффузия, способность к набуханию в больших пределах, оптическая активность, подвижность в электрическом поле, низкое осмотическое давление и высокое онкотическое давление, способность к поглощению УФ-лучей при 280 нм (это свойство, обусловленное наличием в белках ароматических аминокислот, используется для количественного определения белков).
Белки, как и аминокислоты, амфотерны благодаря наличию свободных NH2- и СООН-групп. Для них характерны все свойства кислот и оснований. В зависимости от реакции среды и соотношения кислых и основных аминокислот белки в растворе несут или отрицательный, или положительный заряд, перемещаясь к аноду или катоду. Это свойство используется при очистке белков методом электрофореза.
Белки обладают явно выраженными гидрофильными свойствами. Растворы белков имеют очень низкое осмотическое давление, высокую вязкость и незначительную способность к диффузии. Белки способны к набуханию в очень больших пределах. С коллоидным состоянием белков связан ряд характерных свойств, в частности явление светорассеяния, лежащее в основе количественного определения белков методом нефелометрии. Этот эффект используется, кроме того, в современных методах микроскопии биологических объектов. Молекулы белка не способны проникать через полупроницаемые искусственные мембраны (целлофан, пергамент, коллодий), а также биомембраны растительных и животных тканей, хотя при органических поражениях, например, почек капсула почечного клубочка (Шумлянского-Боумена) становится проницаемой для альбуминов сыворотки крови и последние появляются в моче.
№9.Высаливание белков.
Высаливание – это добавление к раствору белка нейтральных солей (Na2SO4, (NH4)2SO4). Механизм высаливания заключается во взаимодействии анионов (SO42-) и катионов (Na+, NH4+) с зарядами белка (группы NH4+ и COO–). В результате заряд исчезает, и соответственно, исчезает взаимоотталкивание молекул. Одновременно резко уменьшается гидратная оболочка. Все это приводит к "слипанию" молекул и осаждению.
Так как белки плазмы крови отличаются по размерам, заряду, строению, то можно подобрать такие количества соли, которые вызовут осаждение менее устойчивых белков, пока другие еще будут растворены.
Например, подобным образом раньше определяли соотношение альбумины/глобулины в плазме крови. Альбумины, как более полярные молекулы, остаются в растворенном состоянии при 50% насыщении раствора нейтральными солями, в то время как глобулины в этих условиях уже осаждаются. В норме соотношение альбумины/глобулины в плазме крови равно 1,2-1,8.
№10.Денатурация белков.
Природные белковые тела наделены определенной, строго заданной пространственной конфигурацией и обладают рядом характерных физико-химических и биологических свойств при физиологических значениях температуры и рН среды. Под влиянием различных физических и химических факторов белки подвергаются свертыванию и выпадают в осадок, теряя нативные свойства. Таким образом, под денатурацией следует понимать нарушение общего плана уникальной структуры нативной молекулы белка, преимущественно ее третичной структуры, приводящее к потере характерных для нее свойств (растворимость, электрофоретическая подвижность, биологическая активность и т.д.). Большинство белков денатурирует при нагревании их растворов выше 50–60°С.
Внешние проявления денатурации сводятся к потере растворимости, особенно в изоэлектрической точке, повышению вязкости белковых растворов, увеличению количества свободных функциональных SH-групп и изменению характера рассеивания рентгеновских лучей. Наиболее характерным признаком денатурации является резкое снижение или полная потеря белком его биологической активности (каталитической, антигенной или гормональной). При денатурации белка, вызванной 8М мочевиной или другим агентом, разрушаются в основном нековалентные связи (в частности, гидрофобные взаимодействия и водородные связи). Дисульфидные связи в присутствии восстанавливающего агента меркаптоэтанола разрываются, в то время как пептидные связи самого остова полипептидной цепи не затрагиваются. В этих условиях развертываются глобулы нативных белковых молекул и образуются случайные и беспорядочные структуры.
При непродолжительном действии и быстром удалении денатурирующих агентов возможна ренатурация белка с полным восстановлением исходной трехмерной структуры и нативных свойств его молекулы ,включая биологическую активность. Таким образом, при денатурации белковая молекула полностью теряет биологические свойства, демонстрируя тем самым тесную связь между структурой и функцией. Для практических целей иногда используют процесс денатурации в «мягких» условиях, например при получении ферментов или других биологически активных белковых препаратов в условиях низких температур в присутствии солей и при соответствующем значении рН . При лиофилизации белков (высушивание в вакууме путем возгонки влаги из замороженного состояния) для предотвращения денатурации часто пользуются химическими веществами (простые сахара, глицерин, органические анионы).
№11.Электрические свойства белков.
Белки являются амфотерными полиэлектролитами (полиамфолитами), при этом группами, способными к ионизации в растворе, являются карбоксильные остатки боковых цепей кислых аминокислот (аспарагиновая и глутаминовая кислоты) и азотсодержащие группы боковых цепей основных аминокислот (в первую очередь ε-аминогруппа лизина и амидиновый остаток CNH(NH2) аргинина, в несколько меньшей степени — имидазольный остаток гистидина). Белки как полиамфолиты характеризуются изоэлектрической точкой (pI) — кислотностью среды pH, при которой молекулы данного белка не несут электрического заряда и, соответственно, не перемещаются в электрическом поле (например, при электрофорезе). Величина pI определяется отношением кислотных и основных аминокислотных остатков в белке: увеличение количества остатков основных аминокислот в данном белке ведёт к увеличению pI; увеличение количества остатков кислых аминокислот приводит к снижению значения pI.
Значение изоэлектрической точки является характерной константой белков. Белки с pI меньше 7 называются кислотными, а белки с pI больше 7 — основными. В целом, pI белка зависит от выполняемой им функции: изоэлектрическая точка большинства белков тканей позвоночных лежит в пределах от 5,5 до 7,0, однако в некоторых случаях значения лежат в экстремальных областях: так, например, для пепсина — протеолитического фермента сильнокислого желудочного сока pI ~ 1[9], а для сальмина — белка-протамина молок лосося, особенностью которого является чрезвычайно высокое содержание аргинина, pI ~ 12. Белки, связывающиеся с нуклеиновыми кислотами за счёт электростатического взаимодействия с фосфатными остатками нуклеиновых кислот, часто являются основными белками. Примером таких белков служат гистоны и протамины.
