
Вариант 14
Задача 9
Для реакции, порядок которой указан в таблице 1, за время 2,7 (мин) разлагается 11,9 (%) исходного вещества с начальной концентрацией 0,19 (моль/л). Предполагая, что температура постоянна, рассчитайте и ответьте на вопросы:
1) Сколько времени потребуется для разложения в этих же условиях 9,7 (%) исходного вещества?
2) Какова степень превращения через 9,6 (мин) от начала реакции?
3) Покажите, пользуясь понятием периода полупревращения, общий вид графика зависимости С – t для начального и конечного продуктов. Поясните физический смысл скорости по каждому веществу. Как и почему изменяется скорость образования (исчезновения) каждого участника реакции с течением времени?
4) Как изменится вид этого графика при повышении (понижении) температуры?
Решение:
Находим концентрацию реагирующего вещества
C1 = C0·(1 – α1/100 )=0,19*(1-11,9/100)=0,16739 моль/л
Для нахождения константы скорости k используем уравнение
![]() (мин-1)
(мин-1)
1) C =C 0·(1 – α/100 ) = 0,19·(1 – 9,7/100) = 0,17157 (моль/л);
t= (1/ k) (1/C-1/C0) = (1/0,2633(1/0,17157-1/0,19)=2,15 (мин)
2) Из уравнения C = C0/(1+ktC0) находим концентрацию реагирующего вещества в момент времени 9,6 мин: C = 0,19/(1+0,2633·9,6·0,19) = 0,1284 (моль/л);
α = 100(%)(C0 – C)/C0 = 100(%)(0,19– 0,1285)/0,19 = 32,44 (%).
3) Этот график легко построить, пользуясь тем, что за время, равное периоду полупревращения, концентрация реагирущего вещества уменьшаеся вдвое. Для реакций 2-го порядка период полупревращения t1/2 постоянен, он не зависит от концентрации реагирующего вещества и времени: t1/2 = 1/(kC0).
Скорость химической реакции – это изменение концентраии реагирующих веществ в единицу времени, т.е. dC/dt. На графиках
C – t скорость реакции – это крутизна, т.е. тангенс угла наклона линии в данной точке. В соответствии с уравнениями, v = kC. Поэто при уменьшении концентрации исходного вещества скорость v должна уменьшаться, т.е. крутизна линий на рисунке с течением времени уменьшается.
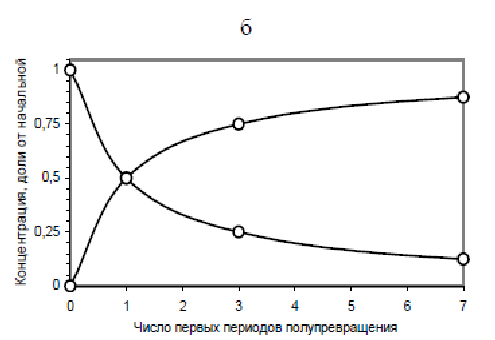
4) При повышении температуры скорость химической реакции быстро возрастает, а период полупревращения, соответственно, уменьшается. Поэтому кривые C – t на рисунке пойдут круче. При понижении температуры линии пойдут более полого.
Ответ: t=2,15 (мин); α =32,44 (%).
Задача 10
При температуре 19,8 (ºC) рассматриваемая реакция проходит на 53,8 (%) за время 3,4 (ч), а при температуре 49,2 (ºC), тех же начальных условиях и той же степени превращения за время – 4,9 (мин)
1) Рассчитайте энергию активации (кДж/моль) для этой реакции.
2) Определите температурный коэффициент скорости данной реакции.
3) За какое время реакция пройдет при тех же начальных и конечных условиях при температуре 74,4 (ºC)
Решение:
1) Рассчиатем энергию активации по уравнению
![]()
EA
= R·ln![]() /(
/(![]() =8,31441·ln
=8,31441·ln![]() /(
/(![]() =99583(Дж/моль)
= 99,6 (кДж/моль)
=99583(Дж/моль)
= 99,6 (кДж/моль)
2) Величину температурного коэффициента скорости γ определяем по уравнению

также заменив отношение констант отношением интервалов времени. После
логарифмирования этого уравнения имеем:
ln(0,8·60/4,9) = ((49,2 – 19,8)/10)·lnγ lnγ = 1,2683 → γ = 3,6.
3) Из уравнения (1) получаем:
lnτ3 = lnτ1 – (EA/R)(1/T1 – 1/T3) = ln3,4*60 – (99600/8,31441)(1/292,95 – 1/347,55)= –1,1059;
τ3 = 0,33 (мин.).
Ответ: EA =99,6 (кДж/моль); γ = 3,6; τ3 = 0,33 (мин.).
Задача 11
Рассчитайте для заданной температуры (таблица 5) давление насыщенного пара над капельками ацетона диаметром 15,8 (нм). Давление насыщенного пара жидкости при этой температуре равно 84,4 (мм рт. ст.), плотность жидкости – 807,8 (кг/м3 ), поверхностное натяжение – 0,02568 (Дж/м2 ).
Поясните на этом примере явление изотермической перегонки. Какова причина повышения давления насыщенного пара над малыми капельками по сравнению с плоской поверхностью?
Решение:
Давление насыщенного пара над капельками жидкости радиуса r может быть вычислено по уравнению Кельвина
![]()
где P0 - давление пара жидкости с плоской поверхностью (табличное), Pr - над капельками жидкости радиуса г, а V - молярный объем жидкости.
Вычисляем молярный объем воды для подстановки в уравнение :
V = M/р = 0,058 (кг/моль)/807,8 (кг/м3) = 7,18*10-5 (м3/моль).
Радиус капелек равен d/2 = 7,9*10-9 м.
lnPr/P0 = 2σ V/RTr = 2*0,02568*7,18*10 -5/(8,31441*277,35*7,9*10-9) = 0,2024.
Pr/P0 = 1,2245 → Pr = 1,2245*84,4 (мм рт. ст.) = 103,4 (мм рт. ст.)
Таким образом, найденное для заданных капелек воды давление насыщенного пара существенно превышает давление пара объемной фазы воды с плоской поверхностью. Поэтому при одинаковой температуре жидкой воды и таких капелек будет наблюдаться самопроизвольный процесс испарения капелек и конденсации пара на поверхности жидкой воды, т.е. будет происходить изотермическая перегонка воды из капелек в объемную фазу воды.
Ответ: Pr =103,4 (мм рт. ст.)
Задача 12
Поясните физический смысл явления капиллярной конденсации. При каком диаметре капилляров адсорбента (d, А) начнется капиллярная конденсация гексана (таблица 7) при температуре (9,2 °C и степени насыщения (влажности) воздуха, равной 76 (%)? Предполагается, что жидкость полностью смачивает стенки капилляров. Давление насыщенного пара жидкости при этой температуре равно 72,7 мм.рт.ст, плотность жидкости – 569,0, поверхностное натяжение- 0,01959.
Решение:
Для решения этой задачи используем уравнение.
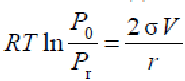
Молярный объем гексана равен:
V = M/р = 0,086 (кг/моль)/569,0 (кг/м3) = 1,511*10-4 (м3/моль).
Степень насыщения воздуха парами гексана (β = 76 %) позволяет определить давление, при котором начнется капиллярная конденсация:
Рг = Ро*β/100 = 72,7*76/100 = 55,25 (мм рт. ст.).
Вычисляем величину lnP0/Pr:
lnP0/Pr = ln72,7/55,25 = 0,2745.
Подставляем это значение в уравнение:
r = 2σV/(RTlnP0/Pr) = 2*0,01959*1,511*10-4/8,31441*282,35*0,2745 =
= 9,187*10-9 (м) (91,87 А) ; d = 183,7 (А).
Ответ: d = 183,7 (А)
Задача 13
Процесс адсорбции данного вещества с молярной массой 179 углем из раствора описывается изотермой адсорбции Лэнгмюра с заданными коэффициентами а∞=0,2245 и b=11,0 (таблица 9).
Поясните физический смысл этих коэффициентов. Рассчитайте равновесную концентрацию С (моль/л) и степень извлечения а (%) этого вещества из раствора адсорбентом, если навеску угля массой 4,4 (г) поместили в 85 (мл) раствора с концентрацией 1,16 (моль/л).
Решение:
В этой задаче величина адсорбции может быть выражена двумя способами: - по уравнению Лэнгмюра:
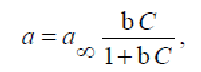
где а∞- предельная адсорбция (моль/г), равная а∞ (г/г)/М;
- через изменение концентрации адсорбируемого вещества в растворе в результате его адсорбции углем:
а(моль/г) = (С0 - С)*V/(m-1000).
В последнем уравнении С0 - начальная концентрация вещества, С - равновесная концентрация адсорбируемого вещества, которые могут быть определены аналитически до начала опыта и после установления равновесия адсорбции.
В обоих уравнениях а и С - одни и те же равновесные величины адсорбции и концентрации адсорбируемого вещества. Приравнивая правые части этих уравнений, получаем величину С, из которой находим искомую степень извлечения вещества углем:
α = (С0 - С)/С0(100%).
0,2245/179*11С/(1+11С)=(1,16-С)*85/(4,4*1000)
0,714С=(1,16-С)*(1+11С)
0,714С =1,16+11,76С-11С2
11С2 – 11,046С-1,16=0
С2 – 1,0042С-0,1055=0
С=1,1 моль/л
α = (1,16 – 1,1)/1,16(100%)=0,052=5,2%.
Ответ: С=1,1 моль/л; α =5,2%.
