
- •Федеральное агентство по образованию российской федерации фгоу впо «Восточно-Сибирский государственный технологический университет»
- •Лекция № 1. Введение. Питание микроорганизмов.
- •1.2. Главные и минорные биоэлементы
- •Лекция №2. Усвоение углеводов отличных от глюкозы
- •Лекция № 3. Рост микроорганизмов на с1 субстратах
- •Лекция № 4. Оптимизация процессов ферментации
- •Лекция № 5. Кинетика ферментативных реакций
- •Лекция № 6. Кинетические модели роста культур микроорганизмов
- •6.1.1. Простейшая схема взаимодействия клетки с субстратом
- •6.2. Пределы скорости роста культур микроорганизмов
- •Лекция № 7. Экспоненциальная фаза роста культур микроорганизмов
- •7.1 Определение параметров роста культуры
- •Лекция № 8. Многосубстратные микробные процессы
- •8.1. Простейшие кинетические схемы
- •Лекция № 9. Ингибирование и активация роста микроорганизмов
- •Лекция № 10. Влияние рН на кинетику роста микроорганизмов
- •Лекция №11. Интегральная форма уравнения роста микробной популяции
- •11.1. Замедление скорости роста культуры микроорганизмов при большой плотности популяции
- •11.2. Интегральная форма уравнения роста культуры микроорганизмов
- •Лекция №12. Ингибирование роста популяции микроорганизмов избытком субстрата
- •Лекция № 13. Ингибирование роста популяции микроорганизмов продуктами ферментации
- •13.1. Ингибирование продуктом на стадии взаимодействия субстрата с клеткой
- •13.2. Ингибирование продуктом на стадии деления клетки
- •13.3. Одновременное ингибирование продуктом обеих стадий
- •Лекция №14. Анализ полных кинетических кривых роста
- •14.1. Конкурентное ингибирование продуктом реакции
- •14.3. Определение механизма ингибирования из вида кинетической кривой роста популяции микроорганизмов
- •Лекция № 15. Периоды индукции на кинетических кривых роста микроорганизмов
- •15.1. Трансформация пресубстрата в субстрат
- •15.2. Адаптационный процесс
- •15.3. Расходуемый ингибитор роста
- •15.4. Дискриминация механизмов и определение кинетических параметров
- •Лекция № 16. Культивирование микроорганизмов в режиме хемостата
- •16.1. Неосложненный рост
- •16.1.1. Определение параметров роста культуры из данных по стационарным состояниям компонентов процесса
- •16.2. Ингибирование субстратом
- •16.2.1. Стационарные уровни концентрации субстрата
- •16.2.2. Стационарные уровни концентрации биомассы и продукта ферментации
- •Лекция №17. Ингибирование продуктом
- •17.1. Конкурентное ингибирование продуктом
- •17.2. Неконкурентное ингибирование продуктом
- •Лекция №18. Ингибирование ионами водорода
- •Списик использованной литературы.
Лекция №18. Ингибирование ионами водорода
При культивировании микроорганизмов весьма часто реализуется ситуация, когда продуктом ферментационного превращения являются органические кислоты, например уксусная или молочная кислоты, которые смещают рН в область низких значений и тем самым изменяют скорость роста культуры. Если ингибирование ионами водорода достаточно сильное, то без специальных приемов вообще невозможно реализовать рост культуры в режиме хемостата.
Проиллюстрируем
это на простом примере. Допустим, скорость
роста культуры контролируется ионогенной
группой с рК~7,0.
Это означает, что константа ингибирования
Н +
роста
культуры Ki=10-7
М. Из предыдущего раздела следует, что
стационарные концентрации субстрата
и биомассы в режиме хемостата
определяются безразмерным параметром
![]() .
Если
принять KS~10-3М
(наиболее типичное значение для
лимитирующего субстрата — источника
углерода) и
.
Если
принять KS~10-3М
(наиболее типичное значение для
лимитирующего субстрата — источника
углерода) и
![]() то
при S0,
соизмеримых с
KS,
из
уравнения (17.54) следует, что Sст/S0
= 0,999. Это говорит о том, что субстрат в
хемостате практически не конвертируется,
роста культуры не происходит.
то
при S0,
соизмеримых с
KS,
из
уравнения (17.54) следует, что Sст/S0
= 0,999. Это говорит о том, что субстрат в
хемостате практически не конвертируется,
роста культуры не происходит.
Для предотвращения ингибирования кислотным продуктом можно, например, в ферментер с постоянной скоростью v0 подавать нейтрализующий кислоту раствор щелочи определенной концентрации. Рассмотрим стационарную кинетику роста культуры с учетом этого дополнительного процесса.
Кинетику роста культуры описывает система уравнений
![]() (18.1)
(18.1)
![]() (18.2)
(18.2)
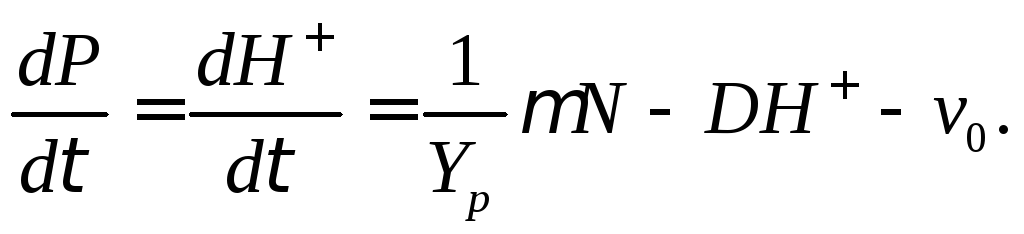 (18.3)
(18.3)
Добавочный
член v0
в (18.3) представляет собой молярную
скорость ввода в ферментер нейтрализующего
раствора (ограничение на v0
накладывается исходя
![]() ).
).
v0 = dОН - /dτ. (18.4)
Зависимость удельной скорости роста культуры от концентрации ионов водорода можно представить в виде
![]() (неконкурентное
ингибирование), (18.5)
(неконкурентное
ингибирование), (18.5)
где функция f(Н+) для различных случаев может иметь различный вид. Например, если имеет место сигмоидальная зависимость скорости роста от концентрации ионов водорода
![]() (18.6)
(18.6)
при колоколообразной
![]() (18.7)
(18.7)
В
стационарном режиме при
![]() имеем
имеем
![]() (18.8)
(18.8)
![]() (18.9)
(18.9)
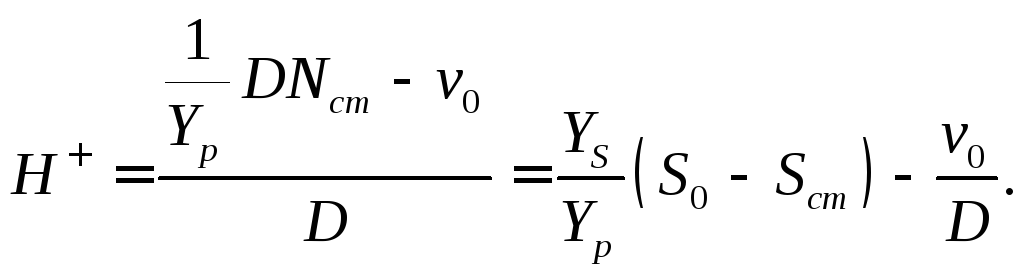 (18.10)
(18.10)
Если рассмотреть простейший случай и предположить, что протон является конкурентным ингибитором роста культуры, то
 (18.11)
(18.11)
При подстановке в это уравнение значения Н + , найденного по уравнению (18.10), получим
 (18.12)
(18.12)
откуда следует
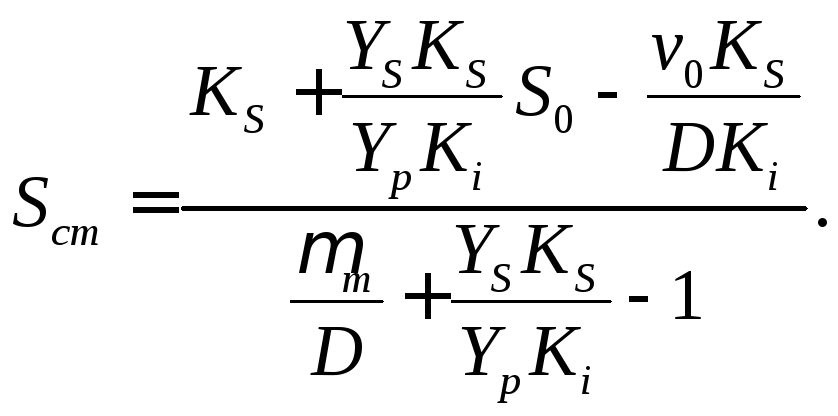 (18.13)
(18.13)
Если
принять введенное ранее обозначение
![]() то
уравнение
(18.13) можно записать в виде
то
уравнение
(18.13) можно записать в виде
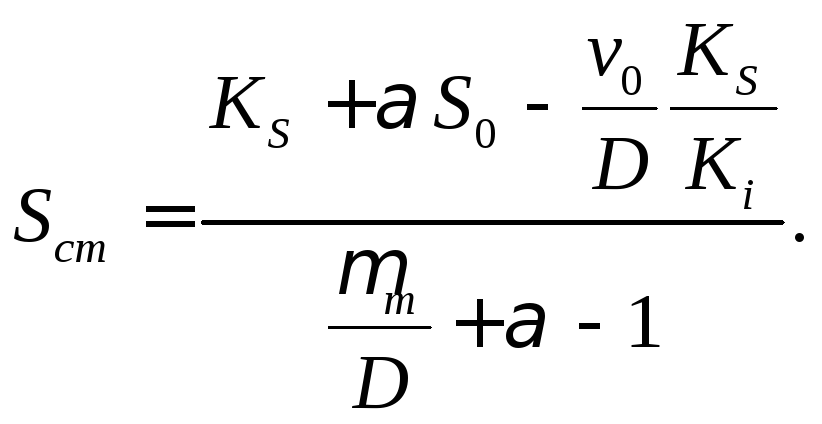 (18.14)
(18.14)
В
отличие от рассмотренного ранее уравнения
для случая ингибирования без процесса
нейтрализации уравнение (18.14) содержит
в числителе дополнительный член
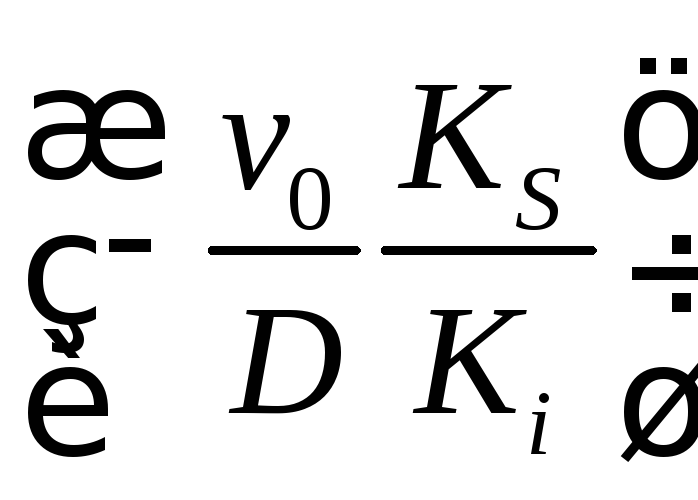 .
Этот член приводит к тому, что при прочих
равных условиях при нейтрализации
кислого продукта стационарная концентрация
субстрата ниже и соответственно
концентрация биомассы выше, чем для
процесса без нейтрализации.
.
Этот член приводит к тому, что при прочих
равных условиях при нейтрализации
кислого продукта стационарная концентрация
субстрата ниже и соответственно
концентрация биомассы выше, чем для
процесса без нейтрализации.
В режиме нейтрализации кислоты концентрация биомассы будет представлена уравнением
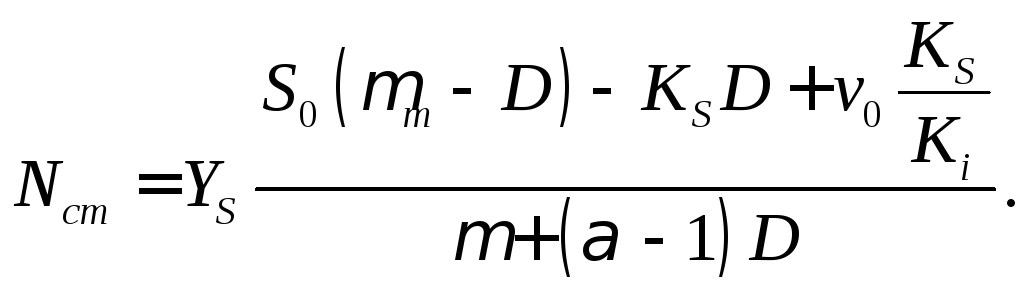 (18.15)
(18.15)
Дополнительный прирост биомассы при нейтрализации кислотного продукта имеет вид
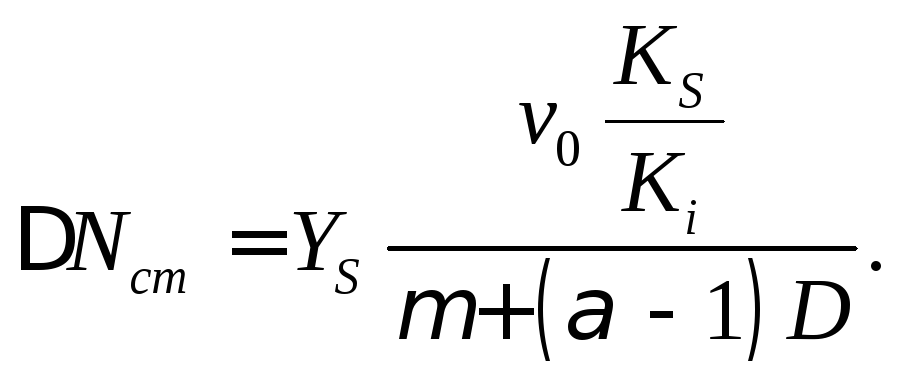 (18.16)
(18.16)
Из этого уравнения видно, что прирост биомассы при нейтрализации кислотного продукта тем выше, чем выше скорость подачи нейтрализующего агента. Прирост биомассы уменьшается с ростом скорости разбавления.
При
проведении процесса с нейтрализацией
кислотного компонента накладываются
дополнительные ограничения на скорость
разбавления. Из уравнения (18.6) следует,
что при
![]() ,
для того чтобы значениеSст
было положительным, т. е. чтобы величина
имела физический смысл, необходимо
соблюдение неравенства
,
для того чтобы значениеSст
было положительным, т. е. чтобы величина
имела физический смысл, необходимо
соблюдение неравенства
![]() (18.17)
(18.17)
Это неравенство будет хорошо выполняться при высоких концентрациях субстрата или при высоких скоростях протока. Критическая скорость разбавления, которая вычисляется на основе равенства нулю числителя уравнения (18.16), имеет вид
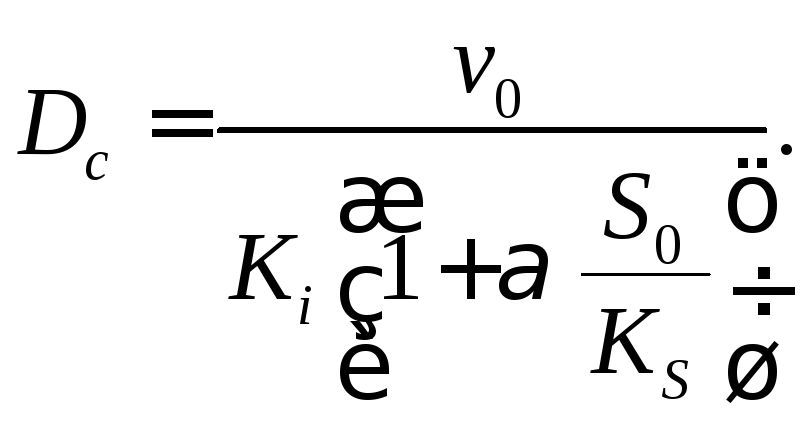 (18.18)
(18.18)
Ниже этой величины стационарного роста культуры в хемостате происходить не будет.
Таким образом, в режиме ингибирования ионами водорода при нейтрализации кислотного продукта скорость разбавления имеет ограничение как сверху, так и снизу:
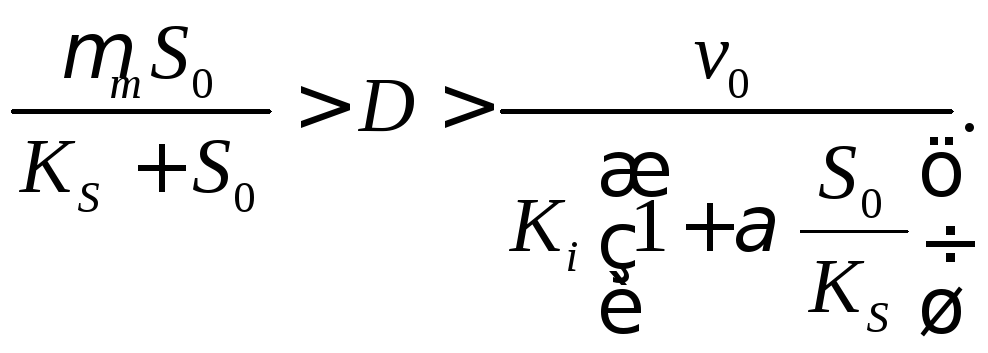 (18.19)
(18.19)
Для определения параметров роста культуры в обсуждаемом режиме необходимо провести исследование стационарных уровней субстрата и биомассы при различных концентрациях вводимого субстрата и различных скоростях разбавления.
Зависимость стационарной концентрации субстрата как функции концентрации вводимого субстрата следующая:
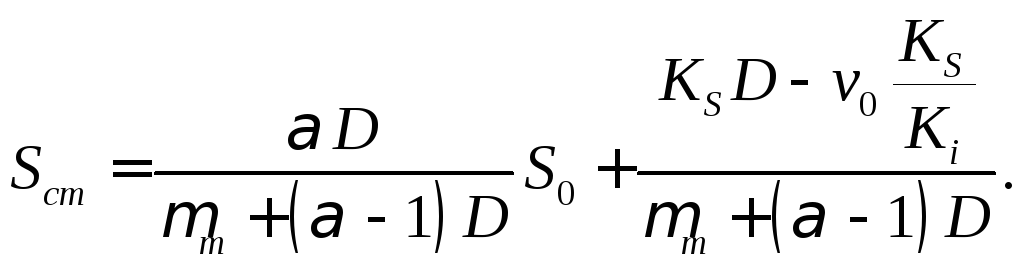 (18.20)
(18.20)
Тангенс угла наклона этой зависимости как функции скорости разбавления определяется максимальной скоростью роста организма и α:
![]() (18.21)
(18.21)
В обратных координатах имеем
![]() (18.22)
(18.22)
Эта зависимость позволяет определить значения α и μm (или отношение μm/α при α>>1).
Отрезок, отсекаемый линейной зависимостью Sст от S0 на оси ординат, равен
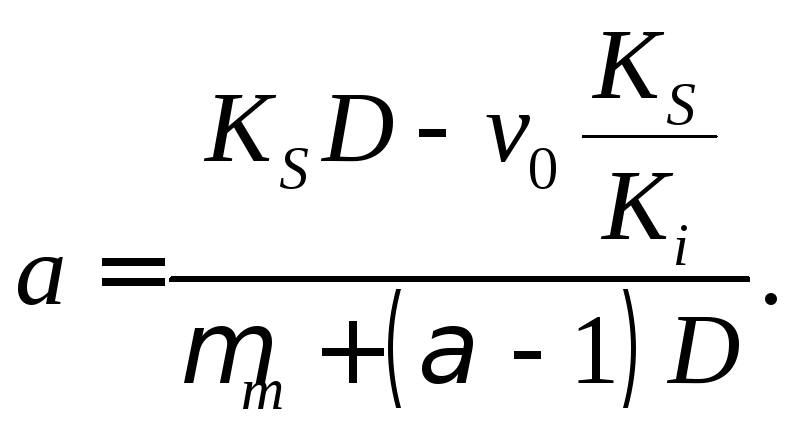 (18.23)
(18.23)
Если известны значения μm, α, v0 , то из зависимости а от D могут быть найдены КS и Кi.
Аналогичное рассмотрение может быть проведено для определения параметров роста микроорганизмов из зависимости стационарного уровня биомассы от начальной концентрации субстрата и скорости разбавления.
Заключение по росту микроорганизмов в режиме хемостата
Культивирование микроорганизмов в проточном режиме имеет ряд принципиальных преимуществ по сравнению с периодическим культивированием. Эти преимущества обеспечивают широкое распространение методов проточного культивирования для решения как исследовательских, так и прикладных задач. Основные преимущества связаны с интенсификацией процесса, возможностями осуществить непрерывное культивирование, автоматическим кондиционированием среды, стабилизацией развития клеток в определенной фазе роста. Принципиальной особенностью хемостатного культивирования является управление скоростью роста популяции с помощью скорости разбавления. Увеличение скорости разбавления автоматически ведет к установлению в системе новой удельной скорости роста популяции и новых стационарных уровней субстрата, биомассы, продуктов ферментации. Однако следует помнить о принципиальном ограничении, накладываемом на скорость разбавления. При определенной вводимой в ферментер концентрации субстрата она не может быть больше максимальной удельной скорости роста микроорганизма в данных условиях. При скорости разбавления выше критической культура микроорганизмов будет «вымываться» из ферментера.
Уравнения, описывающие рост популяции в режиме хемостата, наиболее просты. Для определения параметров роста, таких, как удельная максимальная скорость роста и константа сродства к субстрату, необходимо исследовать поведение системы при различных скоростях разбавления или различных начальных концентрациях субстрата и использовать уравнения, которые следуют из изложенной теории хемостатного роста. Соответствие экспериментальных данных уравнениям для случая неосложненного роста является доказательством того, что рост популяции протекает в условиях отсутствия осложняющих эффектов. Если наблюдаются существенные отклонения от уравнений «идеального» роста, то необходимо провести идентификацию осложняющего эффекта. Это может быть как ингибирование избытком субстрата, так и ингибирование продуктом культивации микроорганизма.
В случае неосложненного роста стационарная концентрация субстрата должна сильно возрастать с ростом скорости разбавления, в то время как при сильном ингибировании субстратом она может как линейно расти, так и сильно падать. При ингибировании продуктом стационарная концентрация субстрата должна расти с ростом скорости разбавления по гиперболическому закону. Напротив, в случае ингибирования продуктом должна наблюдаться линейная зависимость между стационарной концентрацией субстрата в ферментере и в питающем его растворе. Совершенно различны закономерности изменения в ферментере биомассы при изменении скорости разбавления. На основании качественного сопоставления экспериментальных данных с теоретическими, представленными можно идентифицировать условия роста популяции, определить в последующем параметры процесса и найти наиболее оптимальные условия его проведения.
